
Ethylenoxidstruktur, Eigenschaften, Risiken und Verwendungen
Das Ethylenoxid Es ist eine organische Verbindung aus der Epoxidfamilie. Bei Raumtemperatur ist es gasförmig, farblos und obwohl es fast geruchlos ist, hat es einen milden süßen Geruch, ähnlich dem von Ethern..
Es ist ein sehr vielseitiger chemischer Baustein, da es in einer Vielzahl von industriellen Anwendungen zur Herstellung anderer chemischer Verbindungen mit mehreren Verwendungszwecken verwendet wird. Dies liegt an seiner hohen Reaktivität, dh seiner leichten Reaktion mit anderen Substanzen..
Eine seiner Hauptanwendungen ist als Rohstoff bei der Herstellung von Frostschutzkomponenten für Fahrzeugkühler. Seine Derivate werden als Inhaltsstoffe in Industrie- oder Haushaltsreinigern, kosmetischen Produkten und Shampoos, Weichmachern, pharmazeutischen Präparaten oder Salben verwendet..
Es ist ein weit verbreitetes Desinfektionsmittel, beispielsweise bei der Sterilisation von medizinischen und zahnmedizinischen Geräten, da es Viren, Bakterien, Pilze und Sporen insbesondere unter trockenen Bedingungen zerstören kann. Darüber hinaus wurde es verwendet, um Lebensmittelprodukte für Verpackungen zu begasen, obwohl diese Verwendung in Frage gestellt wird.
Trotz seiner Nützlichkeit sollte es mit äußerster Vorsicht behandelt werden, da es Augen- und Hautreizungen verursachen kann. Das Einatmen von Ethylenoxid über einen längeren Zeitraum kann das Nervensystem beeinträchtigen. Daher sollten Personen, die ihren Dämpfen oder Lösungen ausgesetzt sind, Schutzausrüstung und Kleidung tragen..
Artikelverzeichnis
- 1 Struktur
- 2 Eigenschaften
- 2.1 Andere Namen
- 2.2 Physischer Zustand
- 2.3 Molekulargewicht
- 2.4 Flammpunkt
- 2.5 Dichte
- 2.6 Löslichkeit
- 2.7 Selbstentzündungstemperatur
- 2.8 Andere Eigenschaften
- 3 Produktion
- 4 Risiken
- 4.1 Für die Gesundheit
- 4.2 Feuer
- 5 Verwendungen
- 5.1 Industrielle Anwendungen
- 5.2 Medizinische Anwendungen
- 5.3 Bibliotheken und Museen
- 5.4 Landwirtschaft und Ernährung
- 6 Referenzen
Struktur
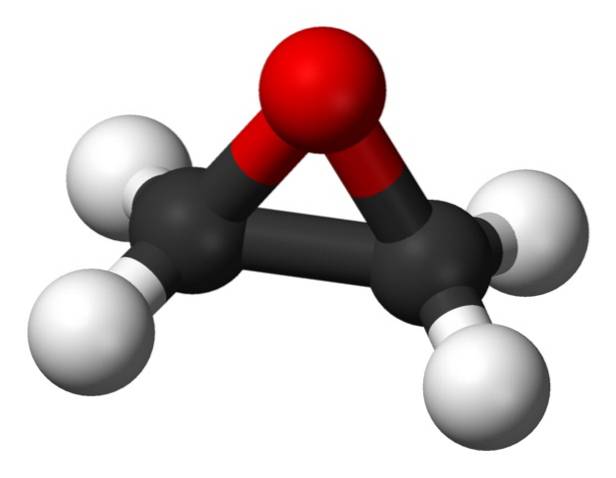
Seine Summenformel lautet C.zweiH.4O. Es gehört zur Gruppe der Epoxide und ist die einfachste und wichtigste davon. Es ist wie ein dreigliedriger Ring geformt.
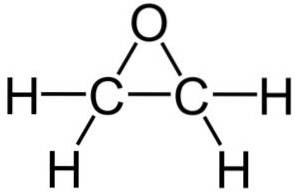
Ethylenoxid ist aufgrund seiner dreieckigen Ringstruktur sehr reaktiv, was auf die Leichtigkeit zurückzuführen ist, mit der sich der Ring öffnet. Im Durchschnitt betragen die Bindungswinkel 60 °, was Ihre Bindungen schwach macht. Das Molekül ist weniger stabil als das eines linearen Ethers und neigt dazu, leicht mit anderen chemischen Verbindungen zu reagieren..
Eigenschaften
Andere Namen
- Oxirano.
- Epoxyethan.
Körperlicher Status
Bei Raumtemperatur und unter atmosphärischem Druck ist es ein Gas. Unter 10,6 ºC und unter atmosphärischem Druck ist es eine Flüssigkeit. Unter -111 ºC ist es ein Feststoff.
Molekulargewicht
44,05 g / mol.
Flammpunkt
Weniger als -17,8 ° C.
Dichte
Seine Dichte ist niedriger als die von Wasser und beträgt 0,882 bei 10 ºC. Die Dämpfe sind wiederum schwerer als Luft.
Löslichkeit
Es ist in Wasser, Benzol, Aceton, Ethanol und Ether löslich. Es ist mit Tetrachlorkohlenstoff mischbar.
Selbstentzündungstemperatur
428,9 ºC.
Andere Eigenschaften
- Wenn es erhitzt oder verunreinigt wird, kann es exotherm polymerisieren (wodurch große Wärmemengen entstehen). Wenn die Polymerisation in einem Behälter auftritt, kann sie heftig reißen.
- Kann mit oxidierenden Materialien reagieren.
- Es ist extrem giftig, krebserregend und ein guter Generator für Mutationen in Bakterien und Säugetierzellen..
Produktion
Im industriellen Maßstab wird es durch Oxidation von Ethylen mit Sauerstoff (O) hergestelltzwei) aus der Luft. Die Geschwindigkeit dieser Reaktion nimmt mit der Anwesenheit von Silbermetall (Ag) und der Wirkung der Temperatur zu. Die Reaktion ist unten gezeigt:
Ag, 250ºC
2 C.zweiH.4 + ODERzwei -> 2CzweiH.4ODER
Ethylen Ethylenoxid
Risiken
Für die Gesundheit
- Es wurde berichtet, dass es neurologische Störungen verursacht und zum Tod führen kann. Die niedrigste Konzentration, die beim Einatmen toxische Wirkungen hervorrufen kann, beträgt 12.500 ppm / 10 Sekunden (ppm bedeutet: parts per million).
- Es ist ein starker Reizstoff für Haut, Augen und Atemwege..
- Die Einwirkung hochkonzentrierter Ethylendämpfe kann zu Augenreizungen, Entzündungen der Augenmembran und Hornhautschäden führen..
- Die Entwicklung von Katarakten wurde mit der Exposition gegenüber seinen Dämpfen und Spritzern in Verbindung gebracht. Konzentrierte Lösungen verursachen schwere Augenschäden.
- Der Kontakt von wässrigen Ethylenoxidlösungen mit der Haut führt zu Reizungen und kann zu schwerer Dermatitis mit Blasen und Verbrennungen führen..
- Einatmen kann das Nervensystem beeinträchtigen und unter anderem Kopfschmerzen und Übelkeit verursachen..
Feuer
- Bei Flammen oder Hitze besteht Explosionsgefahr. Beim Erhitzen entstehen gefährliche Dämpfe.
- Dampf bildet mit Luft in einem weiten Konzentrationsbereich explosive Gemische.
- Vermeiden Sie den Umgang mit Geräten, die Metalle wie Kupfer, Silber, Quecksilber, Magnesium, Aluminium oder Eisenoxide enthalten, und vermeiden Sie unter anderem Mittel wie Ammoniak, Oxidationsmittel, organische Säuren oder Basen. Alle diese Materialien können ihre Polymerisation und / oder Explosion beschleunigen.
Anwendungen
Industrielle Anwendungen
Es wird als Vermittler bei der Herstellung anderer Chemikalien verwendet, die wiederum bei der Herstellung von Polyesterfasern für Kleidung, Polster, Teppiche und Kissen verwendet werden..
Ethylenoxid erzeugt das Ethylenglykol, das im Frostschutzmittel für Fahrzeugmotoren verwendet wird. Ethylenglykol wird auch bei der Herstellung von Glasfaser- und Kunststoffverpackungsfolien verwendet..
Andere aus Ethylenoxid hergestellte Chemikalien umfassen nichtionische Tenside, die in Waschmitteln und Geschirrspülformeln verwendet werden..
Medizinische Anwendungen
Es wird als Sterilisationsmittel für medizinische Geräte wie chirurgische Instrumente, Nadeln und Injektionsinjektoren oder Prothesen verwendet.
Es wird unter anderem auch zur Sterilisation von Hämodialysegeräten, Laborgeräten, zahnärztlichen Instrumenten, Veterinärinstrumenten, Thermometern, chirurgischer Kleidung oder Erste-Hilfe-Geräten verwendet..

Obwohl es verschiedene Methoden zur Sterilisation von medizinischen Geräten gibt, kann in einigen Anwendungen keine verfügbare Behandlung Ethylenoxid ersetzen..
Dies ist der Fall bei der Sterilisation bestimmter hitze- und strahlungsempfindlicher Materialien sowie einiger Instrumente und Geräte, die am Einsatzort in Krankenhäusern sterilisiert werden müssen..
Bibliotheken und Museen
An diesen Orten wird Ethylenoxid zur Bekämpfung von Schädlingen wie Pilzen und Insekten eingesetzt. Diese Verwendung ist jedoch nicht so häufig und wird verwendet, wenn andere Alternativen nicht wirksam sind..
Landwirtschaft und Ernährung
Es wurde unter anderem als Pestizid, Fungizid, Begasungsmittel, Herbizid, Insektizid, Rodentizid verwendet. Reduziert die Population von Bakterien und Pilzen in Gewürzen erheblich.
Aus Sicherheits- und Umweltgründen wurde die Verwendung von Ethylenoxid zur Begasung von Lebensmitteln in der Europäischen Union und in den USA verboten..
Verweise
- UNS. Nationalbibliothek für Medizin. (2019). Ethylenoxid. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt
- Chemische Sicherheitsdaten. (2019). Ethylenoxid. Von Chemicsafetyfacts.org wiederhergestellt
- Morrison, Robert Thornton; und Boyd, Robert Neilson. 1992. Organische Chemie. Prentice-Hall.
- Moerman, F. und Mager, K. (2016). Reinigung und Desinfektion in Trockenfutterverarbeitungsbetrieben. Im Handbuch der Hygienekontrolle in der Lebensmittelindustrie (2. Auflage). Von sciendirect.com wiederhergestellt.
- Eastmond, David A. und Balakrishnan, Sharada. (2010). Genotoxizität von Pestiziden. In Hayes 'Handbuch für Pestizidtoxikologie (dritte Ausgabe). Von sciencedirect.com wiederhergestellt
- Atungulu, G.G. und Pan, Z. (2012). Mikrobielle Dekontamination von Nüssen und Gewürzen. In der mikrobiellen Dekontamination in der Lebensmittelindustrie. Von sciencedirect.com wiederhergestellt



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.