
Methoxyethanstruktur, Eigenschaften, Gewinnung, Verwendung, Risiken

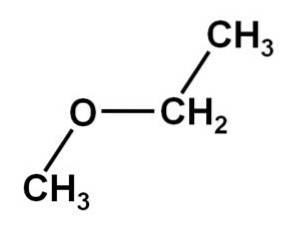
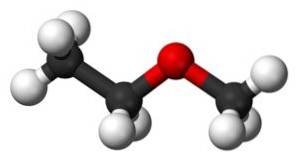
Das Methoxyethan Es ist eine organische Verbindung aus der Familie der Ether oder Alkoxide. Seine chemische Formel lautet CH3OCHzweiCH3. Es wird auch Methylethylether oder Ethylmethylether genannt. Es ist eine gasförmige Verbindung bei Raumtemperatur und sein Molekül hat zwei Methylgruppen -CH3, einer direkt an Sauerstoff und der andere an Ethyl-CH gebundenzweiCH3.
Methoxyethan ist ein farbloses Gas, das in Wasser löslich und mit Ether und Ethylalkohol mischbar ist. Da es sich um einen Ether handelt, handelt es sich um eine schwach reaktive Verbindung, die jedoch bei hohen Temperaturen mit einigen konzentrierten Säuren reagieren kann..
Es wird im Allgemeinen durch die sogenannte Williamson-Synthese erhalten, die die Verwendung eines Natriumalkoxids und eines Alkyliodids umfasst. Die Zersetzung wurde wiederum unter verschiedenen Bedingungen untersucht.
Methoxyethan wird in Forschungslabors mit verschiedenen Zielen eingesetzt, beispielsweise bei der Untersuchung von Halbleiternanomaterialien oder bei der Beobachtung interstellarer Materie in Konstellationen und großen Molekülwolken des Universums..
Dank sehr empfindlicher Teleskope (Interferometer) wurde es an bestimmten Stellen im interstellaren Raum nachgewiesen..
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Physikalische Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Siedepunkt
- 3.5 Flammpunkt
- 3.6 Selbstentzündungstemperatur
- 3.7 Spezifisches Gewicht
- 3.8 Brechungsindex
- 3.9 Löslichkeit
- 4 Chemische Eigenschaften
- 4.1 Wärmezersetzung
- 4.2 Photosensibilisierte Zersetzung
- 5 Erhalten
- 6 Ort im Universum
- 7 Verwendung von Methoxyethan
- 7.1 Für Studien zur interstellaren Materie
- 7.2 Ableitung chemischer Transformationen in verschiedenen Studienbereichen
- 7.3 Mögliche Verwendung in Halbleitern
- 8 Risiken
- 9 Referenzen
Struktur
Die Methoxyethanverbindung hat eine Methylgruppe -CH3 und eine Ethylgruppe -CHzweiCH3 beide an einen Sauerstoff gebunden.
Wie zu sehen ist, gibt es in diesem Molekül zwei Methylgruppen, von denen eine an den Sauerstoff CH gebunden ist3-O und das andere, das zu Ethyl-CH gehörtzwei-CH3.
Im Grundzustand oder im Zustand niedrigerer Energie ist die Methylgruppe von -CHzwei-CH3 ist in Position trans in Bezug auf an Sauerstoff gebundenes Methyl, dh an einer diametral entgegengesetzten Stelle, wobei die CH-Bindung als Referenz genommen wirdzwei-O. Deshalb wird es manchmal genannt trans-Ethylmethylether.
Dieses Molekül kann sich an der CH-Bindung verdrehenzwei-Oder was das Methyl in eine andere räumliche Position bringt als das trans , Methylgruppen -CH3 sind sehr nahe beieinander und diese Torsion erzeugt einen Energieübergang, der von empfindlichen Instrumenten erfasst werden kann.
Nomenklatur
- Methoxyethan.
- Methylethylether.
- trans-Ethylmethylether (hauptsächlich in der englischsprachigen Literatur, Übersetzung aus dem Englischen trans-Ethylmethylether).
Physikalische Eigenschaften
Körperlicher Status
Farbloses Gas
Molekulargewicht
60,096 g / mol
Schmelzpunkt
-113,0 ºC
Siedepunkt
7,4 ºC
Flammpunkt
1,7 ºC (Methode mit geschlossenem Becher).
Selbstentzündungstemperatur
190 ºC
Bestimmtes Gewicht
0,7251 bei 0 ºC / 0 ºC (Es ist weniger dicht als Wasser, aber schwerer als Luft).
Brechungsindex
1,3420 bei 4 ºC
Löslichkeit
In Wasser löslich: 0,83 mol / l
In Aceton löslich. Mit Ethylalkohol und Ethylether mischbar.
Chemische Eigenschaften
Methoxyethan ist ein Ether und daher relativ unreaktiv. Die Kohlenstoff-Sauerstoff-Kohlenstoff-C-O-C-Bindung ist sehr stabil gegen Basen, Oxidations- und Reduktionsmittel. Es wird nur durch Säuren abgebaut, aber es läuft nur unter starken Bedingungen ab, dh mit konzentrierten Säuren und hohen Temperaturen..
Es neigt jedoch dazu, in Gegenwart von Luft zu oxidieren und instabile Peroxide zu bilden. Wenn die Behälter, die es enthalten, Hitze oder Feuer ausgesetzt sind, explodieren die Behälter heftig.
Wärmezersetzung
Wenn Methoxyethan zwischen 450 und 550 ° C erhitzt wird, zersetzt es sich zu Acetaldehyd, Ethan und Methan. Diese Reaktion wird durch die Anwesenheit von Ethyliodid katalysiert, das im Allgemeinen in Methoxyethan-Laborproben vorhanden ist, weil es verwendet wird, um es zu erhalten..
Photosensibilisierte Zersetzung
Mit einer Quecksilberdampflampe (2537 Å Wellenlänge) bestrahltes Methoxyethan zersetzt sich unter Bildung einer Vielzahl von Verbindungen, darunter: Wasserstoff, 2,3-Dimethoxybutan, 1-Ethoxy-2-methoxypropan und Methylvinylether..
Die Endprodukte hängen von der Bestrahlungszeit der Probe ab, da bei fortschreitender Bestrahlung aus den anfänglich gebildeten dann neue Verbindungen entstehen..
Durch Verlängerung der Bestrahlungszeit können auch Propan, Methanol, Ethanol, Aceton, 2-Butanon, Kohlenmonoxid, Ethyl-n-propylether und Methyl-sec-butylether gebildet werden..
Erhalten
Als nicht symmetrischer Ether kann Methoxyethan durch die Reaktion zwischen Natriummethoxid CH erhalten werden3ONa und Ethyliodid CH3CHzweiI. Diese Art der Reaktion wird als Williamson-Synthese bezeichnet.
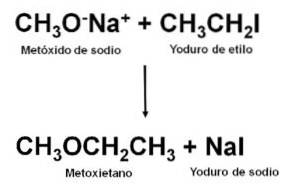
Sobald die Reaktion durchgeführt wurde, wird die Mischung destilliert, um den Ether zu erhalten.
Es kann auch unter Verwendung von Natriumethoxid CH erhalten werden3CHzweiONa und Methylsulfat (CH3)zweiSW4.
Ort im Universum
Das trans-Ethylmethylether wurde im interstellaren Medium in Regionen wie der Orion-Konstellation KL und in der riesigen Molekülwolke W51e2 nachgewiesen.

Der Nachweis dieser Verbindung im interstellaren Raum zusammen mit der Analyse ihrer Häufigkeit hilft, Modelle der interstellaren Chemie zu erstellen..
Verwendung von Methoxyethan
Methoxyethan oder Methylethylether wird hauptsächlich in Laborexperimenten für wissenschaftliche Forschung verwendet.
Für Studien zur interstellaren Materie
Als organisches Molekül mit inneren Rotationen ist Methoxyethan eine chemische Verbindung, die für Untersuchungen interstellarer Materie von Interesse ist..
Die Innenrotationen seiner Methylgruppen erzeugen Energieübergänge im Mikrowellenbereich.
Daher können sie von hochempfindlichen Teleskopen wie dem Atacama Large Millimeter / Submillimeter Ensemble oder ALMA erkannt werden. Atacama Large Millimeter / Submillimeter Array).

Dank seiner Innenrotation und der großen Weltraumobservatorien der trans-Methylethylether wurde im Sternbild Orion und in der riesigen Molekülwolke W51e2 gefunden.
Ableitung chemischer Transformationen in verschiedenen Studienbereichen
Einige Forscher beobachteten die Bildung von Methoxyethan oder Methylethylether, wenn ein Gemisch aus Ethylen-CH mit Elektronen bestrahlt wird.zwei= CHzwei und Methanol CH3Oh.
Der Reaktionsmechanismus geht durch die Bildung des Radikals CH3O •, das die elektronenreiche Doppelbindung von CH angreiftzwei= CHzwei. Das resultierende Addukt CH3-O-CHzwei-CHzwei• fängt einen Wasserstoff aus einem CH ab3OH und bildet den Methylethylether CH3-O-CHzwei-CH3.
Die Untersuchung dieser Art von Reaktionen, die durch Bestrahlung von Elektronen induziert werden, ist auf dem Gebiet der Biochemie nützlich, da festgestellt wurde, dass sie die DNA schädigen können, oder auf dem Gebiet der metallorganischen Chemie, da sie die Bildung von Nanostrukturen begünstigt.
Darüber hinaus ist bekannt, dass große Mengen an Sekundärelektronen erzeugt werden, wenn elektromagnetische oder teilchenförmige Strahlung mit kondensierter Materie im Raum wechselwirkt..
Daher wird geschätzt, dass diese Elektronen chemische Transformationen in interstellarer Staubmaterie auslösen können. Daher ist es wichtig, Methylethylether bei diesen Reaktionen zu untersuchen..
Mögliche Verwendung in Halbleitern
Einige Wissenschaftler fanden heraus, dass Methoxyethan oder Methylethylether durch mit Gallium (Ga) dotiertes Graphen adsorbiert werden können (beachten Sie, dass sich die Adsorption von der Absorption unterscheidet)..
Graphen ist ein Nanomaterial aus Kohlenstoffatomen, die in einem hexagonalen Muster angeordnet sind..

Die Adsorption von Methoxyethan an dotiertem Graphen erfolgt durch die Wechselwirkung zwischen dem Sauerstoff im Ether und dem Galliumatom auf der Oberfläche des Nanomaterials. Aufgrund dieser Adsorption erfolgt ein Nettoladungstransfer von Ether zu Gallium..
Nach der Adsorption von Methylethylether und aufgrund dieses Ladungstransfers zeigt Gallium-dotiertes Graphen Halbleitereigenschaften vom p-Typ.
Risiken
Methoxyethan ist leicht entflammbar.
Bei Kontakt mit Luft neigt es zur Bildung instabiler und explosiver Peroxide.
Verweise
- UNS. Nationalbibliothek für Medizin. (2019). Ethylmethylether. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.
- Irvine W.M. (2019) Ethylmethylether (C.zweiH.5OCH3). In: Gargaud M. et al. (Hrsg.). Enzyklopädie der Astrobiologie. Springer, Berlin, Heidelberg. Von link.springer.com wiederhergestellt.
- Drittens haben B. et al. (2015). Suche nach trans-Ethylmethylether in Orion KL. Astronomie & Astrophysik. 582, L1 (2015). Von ncbi.nlm.nih.gov wiederhergestellt.
- Filseth, S.V. (1969). Der Merkur 6 (3P.1) Photosensibilisierte Zersetzung von Methylethylether. Das Journal of Physical Chemistry. Band 73, Nummer 4, April 1969, 793-797. Von pubs.acs.org wiederhergestellt.
- Casanova, J.Jr. (1963). Vorbereitung und Manipulation eines Gas-Methylethyl-Ethers durch Studenten. Journal of Chemical Education. Band 40, Nummer 1, Januar 1963. Von pubs.acs.org wiederhergestellt.
- Ure, W. und Young, J.T. (1933a). Über den Mechanismus gasförmiger Reaktionen. I. Die thermische Zersetzung von Methylethylether. The Journal of Physical Chemistry, Band XXXVII, Nr. 9: 1169–1182. Von pubs.acs.org wiederhergestellt.
- Ure, W. und Young, J.T. (1933b). Über den Mechanismus gasförmiger Reaktionen. II. Homogene Katalyse bei der Zersetzung von Methylethylether. The Journal of Physical Chemistry, 37, 9, 1183–1190. Von pubs.acs.org wiederhergestellt.
- Shokuhi Rad, A. et al. (2017). DFT-Studie zur Adsorption von Diethyl-, Ethylmethyl- und Dimethylethern an der Oberfläche von Gallium-dotiertem Graphen. Angewandte Oberflächenwissenschaft. Band 401, 15. April 2017, Seiten 156-161. Von sciencedirect.com wiederhergestellt.
- Schmidt, F. et al. (2019). Elektroneninduzierte Bildung von Ethylmethylether in kondensierten Gemischen von Methanol und Ethylen. J. Phys. Chem. A 2019, 123, 1, 37-47. Von pubs.acs.org wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.