
Zinn (II) -oxidstruktur, Eigenschaften, Nomenklatur, Verwendung

Das Zinn (II) -oxid ist ein kristalliner anorganischer Feststoff, der durch Oxidation von Zinn (Sn) durch Sauerstoff gebildet wird, wobei Zinn eine 2+ -Valenz erhält. Seine chemische Formel lautet SnO. Es sind zwei verschiedene Formen dieser Verbindung bekannt: schwarz und rot. Die übliche und stabilste Form bei Raumtemperatur ist die schwarze oder bläulich-schwarze Modifikation..
Diese Form wird durch Hydrolyse von Zinn (II) -chlorid (SnCl) hergestelltzwei) in wässriger Lösung, zu der Ammoniumhydroxid (NH) gegeben wird4OH), um einen hydratisierten Oxidniederschlag von Sn (II) zu erhalten, dessen Formel SnO.xH istzweiOder wo x<1 (x menor que 1).
Das hydratisierte Oxid ist ein weißer amorpher Feststoff, der dann in Gegenwart von NH mehrere Stunden in Suspension auf 60-70ºC erhitzt wird4OH, bis das reine schwarze kristalline SnO erhalten wird.
Die rote Form von SnO ist metastabil. Es kann durch Zugabe von Phosphorsäure (H) hergestellt werden3PO4) - mit 22% Phosphorsäure, H.3PO3 - und dann NH4OH zu einer SnCl-Lösungzwei. Der erhaltene weiße Feststoff wird in der gleichen Lösung etwa 10 Minuten lang auf 90-100ºC erhitzt. Auf diese Weise wird das rein rote kristalline SnO erhalten.
Zinn (II) -oxid ist ein Ausgangsmaterial für die Herstellung anderer Zinn (II) -Verbindungen. Aus diesem Grund ist es eine der Zinnverbindungen, die eine nennenswerte wirtschaftliche Bedeutung hat..
Zinn (II) -oxid hat eine geringe Toxizität, wie sie bei den meisten anorganischen Zinnverbindungen auftritt. Dies ist auf seine schlechte Absorption und schnelle Ausscheidung aus dem Gewebe von Lebewesen zurückzuführen..
Es hat eine der höchsten Toleranzen von Zinnverbindungen in Tests an Ratten. Es kann jedoch schädlich sein, wenn es in großen Mengen eingeatmet wird..
Artikelverzeichnis
- 1 Struktur
- 1.1 Blauschwarzes Zinn (II) -oxid
- 1.2 Zinn (II) oxidrot
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Dichte
- 3.5 Löslichkeit
- 3.6 Andere Eigenschaften
- 4 Verwendungen
- 4.1 Bei der Herstellung anderer Zinn (II) -Verbindungen
- 4.2 In Schmuck
- 4.3 Andere Verwendungen
- 4.4 Neueste Innovationen
- 5 Referenzen
Struktur
Blauschwarzes Zinn (II) -oxid
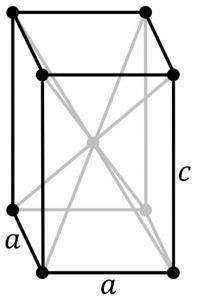
Diese Modifikation kristallisiert mit einer tetragonalen Struktur. Es hat eine Anordnung von Schichten, in denen sich jedes Sn-Atom oben auf einer quadratischen Pyramide befindet, deren Basis aus den 4 nächsten Sauerstoffatomen besteht.
Andere Forscher behaupten, dass jedes Sn-Atom von 5 Sauerstoffatomen umgeben ist, die sich ungefähr an den Eckpunkten eines Oktaeders befinden, wobei der sechste Eckpunkt vermutlich von einem Paar freier oder ungepaarter Elektronen besetzt ist. Dies ist als Φ-oktaedrische Anordnung bekannt.
Zinn (II) oxidrot
Diese Form von Zinn (II) -oxid kristallisiert mit einer orthorhombischen Struktur.
Nomenklatur
- Zinn (II) -oxid
- Zinnoxid
- Zinnmonoxid
- Zinnoxid
Eigenschaften
Körperlicher Status
Kristalliner Feststoff.
Molekulargewicht
134,71 g / mol.
Schmelzpunkt
1080 ºC. Es zersetzt sich.
Dichte
6,45 g / cm3
Löslichkeit
Unlöslich in heißem oder kaltem Wasser. Unlöslich in Methanol, löst sich aber schnell in konzentrierten Säuren und Laugen.
Andere Eigenschaften
Wenn Zinn (II) -oxid in Gegenwart von Luft auf mehr als 300 ºC erhitzt wird, oxidiert es schnell zu Zinn (IV) -oxid und zeigt Glühlampen.
Es wurde berichtet, dass unter nicht oxidierenden Bedingungen das Erhitzen von Zinn (II) -oxid je nach Reinheitsgrad des Ausgangsoxids unterschiedliche Ergebnisse hat. Im Allgemeinen unverhältnismäßig zu metallischem Sn und Zinn (IV) -oxid, SnOzwei, mit verschiedenen Zwischenarten, die schließlich zu SnO werdenzwei.
Zinn (II) -oxid ist amphoter, da es sich in Säuren unter Bildung von Sn-Ionen löstzwei+ oder Anionenkomplexe und löst sich auch in Alkalien unter Bildung von Lösungen von Hydroxytinnationen, Sn (OH)3-, die eine pyramidenförmige Struktur haben.
Darüber hinaus ist SnO ein Reduktionsmittel und reagiert schnell mit organischen und Mineralsäuren..
Es hat eine geringe Toxizität im Vergleich zu anderen Zinnsalzen. Die LD50 (50% letale Dosis oder mittlere letale Dosis) bei Ratten beträgt mehr als 10.000 mg / kg. Dies bedeutet, dass mehr als 10 Gramm pro Kilogramm erforderlich sind, um 50% der Rattenproben unter einem bestimmten Testzeitraum abzutöten. Im Vergleich dazu hat Zinn (II) fluorid bei Ratten eine LD50 von 188 mg / kg..
Wenn es jedoch längere Zeit eingeatmet wird, lagert es sich in der Lunge ab, da es nicht absorbiert wird und Stanose verursachen kann (Infiltration von SnO-Staub in die Lungenzwischenräume)..
Anwendungen
Bei der Herstellung anderer Zinn (II) -Verbindungen
Seine schnelle Reaktion mit Säuren ist die Grundlage seiner wichtigsten Verwendung, die als Zwischenprodukt bei der Herstellung anderer Zinnverbindungen dient..
Es wird zur Herstellung von Zinn (II) -bromid (SnBrzwei), Zinn (II) -cyanid (Sn (CN))zwei) und Zinn (II) fluorborathydrat (Sn (BF)4)zwei), unter anderem Zinn (II) -Verbindungen.
Zinn (II) -fluorborat wird durch Auflösen von SnO in Fluorborsäure hergestellt und für Zinn- und Zinn-Blei-Beschichtungen verwendet, insbesondere für die Abscheidung von Zinn-Blei-Legierungen zum Löten in der Elektronikindustrie. Dies ist unter anderem auf die hohe Deckungskapazität zurückzuführen.
Zinn (II) -oxid wird auch zur Herstellung von Zinn (II) -sulfat (SnSO) verwendet4) durch die Reaktion von SnO und Schwefelsäure, H.zweiSW4.
Das SnSO4 Das erhaltene Produkt wird im Verzinnungsprozess zur Herstellung von Leiterplatten, zur Endbearbeitung elektrischer Kontakte und zum Verzinnen von Küchenutensilien verwendet.

Die hydratisierte Form von SnO, das hydratisierte Zinn (II) -oxid SnO.xHzweiOder es wird mit Flusssäure behandelt, um Zinn (II) -fluorid, SnF, zu erhaltenzwei, Das wird Zahnpasten als Mittel zur Bekämpfung von Hohlräumen zugesetzt.
In Schmuck
Zinn (II) -oxid wird zur Herstellung von Gold-Zinn- und Kupfer-Zinn-Rubinkristallen verwendet. Anscheinend besteht seine Funktion in dieser Anwendung darin, als Reduktionsmittel zu wirken.

Andere Verwendungen
Es wurde in Photovoltaik-Geräten zur Erzeugung von Strom aus Licht wie Solarzellen verwendet.

Neueste Innovationen
Anordnete SnO-Nanopartikel wurden in Kohlenstoffnanoröhrenelektroden für Lithium-Schwefel-Batterien verwendet.

Mit SnO hergestellte Elektroden weisen eine hohe Leitfähigkeit und eine geringe Volumenänderung bei sich wiederholenden Lade- und Entladezyklen auf.
Darüber hinaus ermöglicht SnO einen schnellen Ionen- / Elektronentransfer während Oxidations-Reduktions-Reaktionen, die in solchen Batterien auftreten..
Verweise
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- Bailar, J. C.; Emeléus, H. J.; Sir Ronald Nyholm und Trotman-Dickenson, A.F. (1973). Umfassende anorganische Chemie. Band 2. Pergamonpresse.
- Ullmanns Enzyklopädie der Industriechemie. (1990). Fünfte Ausgabe. Band A27. VCH Verlagsgesellschaft mbH.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Band 24. Vierte Ausgabe. John Wiley & Sons.
- Ostrakhovitch, Elena A. und Cherian, M. George. (2007). Zinn. Im Handbuch der Toxikologie von Metallen. Dritte Edition. Von sciencedirect.com wiederhergestellt.
- Kwestroo, W. und Vromans, P.H.G.M. (1967). Herstellung von drei Modifikationen von reinem Zinn (II) -oxid. J. Inorg. Nucl. Chem., 1967, Bd. 29, S. 2187-2190.
- Fouad, S. S. et al. (1992). Optische Eigenschaften von Zinnoxid-Dünnfilmen. Tschechoslowakisches Journal für Physik. Februar 1992, Band 42, Ausgabe 2. Von springer.com wiederhergestellt.
- A-Young Kim et al. (2017). Bestellte SnO-Nanopartikel in MWCNT als funktionelles Wirtsmaterial für Hochgeschwindigkeits-Lithium-Schwefel-Batteriekathoden. Nano Research 2017, 10 (6). Von springer.com wiederhergestellt.
- Nationalbibliothek für Medizin. (2019). Zinnoxid. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.