
Konfiguration und Verbindungen der Stickstoffvalenzen

Das Stickstoffvalenzen Sie reichen von -3 wie bei Ammoniak und Aminen bis +5 wie bei Salpetersäure (Tyagi, 2009). Dieses Element erweitert Valenzen nicht wie andere.
Das Stickstoffatom ist ein chemisches Element mit der Ordnungszahl 7 und dem ersten Element der Gruppe 15 (ehemals VA) des Periodensystems. Die Gruppe besteht aus Stickstoff (N), Phosphor (P), Arsen (As), Antimon (Sb), Wismut (Bi) und Moscovium (Mc)..

Die Elemente weisen bestimmte allgemeine Ähnlichkeiten im chemischen Verhalten auf, obwohl sie sich chemisch deutlich voneinander unterscheiden. Diese Ähnlichkeiten spiegeln gemeinsame Eigenschaften der elektronischen Strukturen ihrer Atome wider (Sanderson, 2016).
Stickstoff ist in fast allen Proteinen vorhanden und spielt sowohl in biochemischen als auch in industriellen Anwendungen eine wichtige Rolle. Stickstoff bildet starke Bindungen aufgrund seiner Fähigkeit, eine Dreifachbindung mit einem anderen Stickstoffatom und anderen Elementen zu bilden..
Daher ist in Stickstoffverbindungen eine große Energiemenge enthalten. Vor 100 Jahren war wenig über Stickstoff bekannt. Heute wird Stickstoff häufig zur Konservierung von Lebensmitteln und als Dünger verwendet (Wandell, 2016)..
Elektronische Konfiguration und Valenzen
In einem Atom füllen die Elektronen die verschiedenen Ebenen entsprechend ihrer Energie. Die ersten Elektronen füllen die niedrigeren Energieniveaus und bewegen sich dann auf ein höheres Energieniveau.
Das äußerste Energieniveau in einem Atom ist als Valenzschale bekannt, und die in dieser Schale platzierten Elektronen sind als Valenzelektronen bekannt..
Diese Elektronen kommen hauptsächlich in der Bindungsbildung und chemischen Reaktion mit anderen Atomen vor. Daher sind Valenzelektronen für unterschiedliche chemische und physikalische Eigenschaften eines Elements verantwortlich (Valence Electrons, S.F.).
Stickstoff hat, wie zuvor erwähnt, eine Ordnungszahl von Z = 7. Dies impliziert, dass die Füllung der Elektronen in ihrem Energieniveau oder ihrer Elektronenkonfiguration 1S beträgtzwei 2Szwei 2 P.3.
Es muss daran erinnert werden, dass Atome in der Natur immer die elektronische Konfiguration von Edelgasen anstreben, indem sie Elektronen gewinnen, verlieren oder teilen..
Im Fall von Stickstoff ist das Edelgas, das eine elektronische Konfiguration anstrebt, Neon, dessen Ordnungszahl Z = 10 (1S) istzwei 2Szwei 2 P.6) und Helium, dessen Ordnungszahl Z = 2 (1S) istzwei) (Reusch, 2013).
Die verschiedenen Arten, wie Stickstoff kombiniert werden muss, geben ihm seine Wertigkeit (oder Oxidationsstufe). Im speziellen Fall von Stickstoff kann es seine Valenzschale nicht wie die anderen Elemente seiner Gruppe erweitern, da es sich in der zweiten Periode des Periodensystems befindet..
Es werden Valenzen von -3, +3 und +5 erwartet. Stickstoff hat jedoch Valenzzustände im Bereich von -3 wie bei Ammoniak und Aminen bis +5 wie bei Salpetersäure. (Tyagi, 2009).
Die Valenzbindungstheorie hilft, die Bildung von Verbindungen gemäß der Elektronenkonfiguration von Stickstoff für einen bestimmten Oxidationszustand zu erklären. Hierzu ist zu berücksichtigen, wie viele Elektronen sich in der Valenzschale befinden und wie viel noch übrig ist, um die Edelgaskonfiguration zu erhalten..
Stickstoffverbindungen
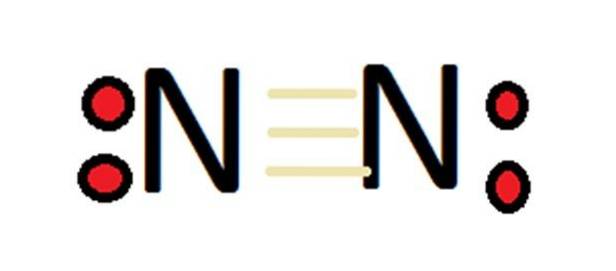
Stickstoff kann aufgrund seiner großen Anzahl von Oxidationsstufen eine große Anzahl von Verbindungen bilden. In erster Linie muss daran erinnert werden, dass im Fall von molekularem Stickstoff per Definition seine Wertigkeit 0 ist.
Die Oxidationsstufe von -3 ist eine der häufigsten für das Element. Beispiele für Verbindungen mit dieser Oxidationsstufe sind Ammoniak (NH3), Amine (R3N), Ammoniumionen (NH)4+), Imine (C = N-R) und Nitrile (C≡N).
In der Oxidationsstufe -2 verbleibt Stickstoff mit 7 Elektronen in seiner Valenzschale. Diese ungerade Anzahl von Elektronen in der Valenzschale erklärt, warum Verbindungen mit dieser Oxidationsstufe eine Brückenbindung zwischen zwei Stickstoffatomen aufweisen. Beispiele für Verbindungen mit dieser Oxidationsstufe sind Hydrazine (R.zwei-N-N-Rzwei) und Hydrazone (C = N-N-Rzwei).
In der Oxidationsstufe -1 verbleibt Stickstoff mit 6 Elektronen in der Valenzschale. Beispiele für Stickstoffverbindungen mit dieser Wertigkeit sind Hydroxylamin (R.zweiNOH) und die Azoverbindungen (RN = NR).
In positiven Oxidationsstufen wird Stickstoff im Allgemeinen an Sauerstoffatome gebunden, um Oxide, Oxysalze oder Oxacide zu bilden. Für den Fall der Oxidationsstufe +1 hat Stickstoff 4 Elektronen in seiner Valenzschale.
Beispiele für Verbindungen mit dieser Valenz sind Distickstoffoxid oder Lachgas (N.zweiO) und Nitrosoverbindungen (R = NO) (Reusch, Oxidationsstufen von Stickstoff, 2015).
Für den Fall der Oxidationsstufe von +2 ist ein Beispiel Stickoxid oder Stickoxid (NO), ein farbloses Gas, das durch die Reaktion von Metallen mit verdünnter Salpetersäure erzeugt wird. Diese Verbindung ist ein extrem instabiles freies Radikal, da sie mit O reagiertzwei in der Luft, um das NO-Gas zu bildenzwei.
Nitrit (NRzwei-) in basischer Lösung und salpetriger Säure (HNOzwei) in saurer Lösung sind Beispiele für Verbindungen mit Oxidationsstufe +3. Dies können Oxidationsmittel sein, um normalerweise NO (g) zu produzieren, oder Reduktionsmittel, um das Nitration zu bilden..
Distickstofftrioxid (N.zweiODER3) und die Nitrogruppe (R-NOzwei) sind weitere Beispiele für Stickstoffverbindungen mit der Wertigkeit +3.
Stickstoffdioxid (NRzwei) oder Stickstoffdioxid ist eine Stickstoffverbindung mit einer Wertigkeit von +4. Es ist ein braunes Gas, das im Allgemeinen durch die Reaktion von konzentrierter Salpetersäure mit vielen Metallen erzeugt wird. Dimerisiert zu N.zweiODER4.
Im + 5-Zustand finden wir Nitrate und Salpetersäure, die in sauren Lösungen Oxidationsmittel sind. In diesem Fall hat Stickstoff 2 Elektronen in der Valenzschale, die sich im 2S-Orbital befinden. (Oxidationsstufen von Stickstoff, S.F.).
Es gibt auch Verbindungen wie Nitrosilazid und Distickstofftrioxid, bei denen Stickstoff verschiedene Oxidationsstufen im Molekül aufweist. Im Fall von Nitrosilazid (N.4O) Stickstoff hat eine Wertigkeit von -1, 0, + 1 und +2; und im Fall von Distickstofftrioxid hat es eine Wertigkeit von +2 und +4.
Nomenklatur der Stickstoffverbindungen
Angesichts der Komplexität der Chemie von Stickstoffverbindungen reichte die traditionelle Nomenklatur nicht aus, um sie zu benennen, geschweige denn, um sie richtig zu identifizieren. Aus diesem Grund hat die Internationale Union für reine und angewandte Chemie (IUPAC) unter anderem eine systematische Nomenklatur erstellt, in der Verbindungen nach der Anzahl der enthaltenen Atome benannt werden..
Dies ist vorteilhaft, wenn es um die Benennung von Stickoxiden geht. Beispielsweise würde Stickoxid als Stickstoffmonoxid und Distickstoffoxid (NO) Distickstoffmonoxid (N) bezeichnetzweiODER).
Zusätzlich entwickelte der deutsche Chemiker Alfred Stock 1919 eine Methode zur Benennung chemischer Verbindungen basierend auf der Oxidationsstufe, die in römischen Ziffern in Klammern geschrieben ist. So würden beispielsweise Stickoxid und Lachgas als Stickoxid (II) bzw. Stickoxid (I) bezeichnet (IUPAC, 2005)..
Verweise
- (2005). NOMENKLATUR DER ANORGANISCHEN CHEMIE IUPAC Empfehlungen 2005. Von iupac.org wiederhergestellt.
- Oxidationsstufen von Stickstoff. (S.F.). Von kpu.ca wiederhergestellt.
- Reusch, W. (2013, 5. Mai). Elektronenkonfigurationen im Periodensystem. Aus chemie.msu.edu wiederhergestellt.
- Reusch, W. (2015, 8. August). Oxidationsstufen von Stickstoff. Von chem.libretexts.org wiederhergestellt.
- Sanderson, R. T. (2016, 12. Dezember). Stickstoffgruppenelement. Von britannica.com wiederhergestellt.
- Tyagi, V. P. (2009). Grundlegende Chemie XII. Neues Delikatessengeschäft: Ratna Sagar.
- Valenzelektronen. (S.F.). Von chemie.tutorvista.com wiederhergestellt.
- Wandell, A. (2016, 13. Dezember). Chemie des Stickstoffs. Von chem.libretexts.org wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.