
Atome und Moleküle

Das Atom es ist die Grundeinheit der Materie. Das Molekül ist das Ergebnis der Vereinigung von zwei oder mehr Atomen, dh Moleküle bestehen aus Atomen.
| Atome | Moleküle | |
|---|---|---|
| Definition | Die Grundeinheit der Materie | Zwei oder mehr Atome, die durch eine Bindung verbunden sind |
| Komposition | Neutronen, Protonen, Elektronen | Gleiche oder unterschiedliche Atome |
| Chemische Verbindungen | Abwesend | Vorhanden |
| Beispiele | Wasserstoff:
Sauerstoff:
Natrium:
Chlor:
| Wasser H.zweiODER:
Glukose C.6H.12ODER6::
Molekularer Sauerstoff O.zwei::
|
Was ist ein Atom??
Atome sind die Grundbausteine des Universums. Die Definition des Atoms ist die geringste Menge an Materie, die die chemischen Eigenschaften des Elements beibehält.
Wenn wir zum Beispiel ein Stück Silber Ag nehmen, das ein Element ist, und es so oft teilen, dass es nicht mehr geteilt werden kann, ohne die Eigenschaften zu verlieren, die es als Silber charakterisieren, sind wir in Gegenwart von ein Silberatom.
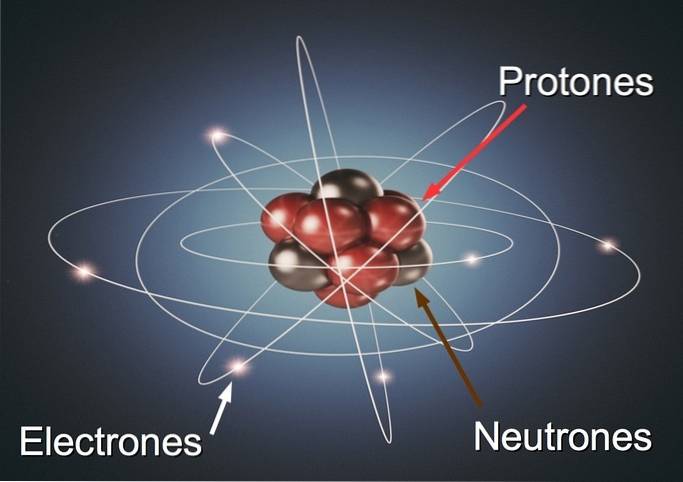
Das Atom besteht aus:
- ein zentraler Kern: bestehend aus Neutronen und Protonen.
- eine elektronische Wolke: Wo sind die Elektronen, die den Kern umgeben?.
Die Anzahl der Protonen, Neutronen und Elektronen bestimmt die Grundstruktur eines Atoms.
Beispiele für Atome
Es gibt so viele Atome wie Elemente im Periodensystem. Sehen wir uns einige Beispiele für Atome und ihre Eigenschaften an.
Wasserstoff H.
Wasserstoff ist das einfachste Atom im Universum und besteht aus einem Proton und einem Elektron. Seine Ordnungszahl ist 1, was es zum ersten Element im Periodensystem macht..
Sauerstoff O.
Sauerstoff ist eines der wichtigsten Elemente für Lebewesen. Seine Ordnungszahl ist 8 und es besteht aus 8 Neutronen, 8 Protonen und 8 Elektronen..
Kohlenstoff C.
Kohlenstoff C ist das Atom, das in allen organischen Verbindungen vorhanden ist; Es hat sechs Neutronen und sechs Protonen im Kern und sechs Elektronen in der Elektronenwolke. Von den sechs Elektronen befinden sich vier in der äußersten Hülle. Dies sind die Elektronen, die zur Bildung von Bindungen mit anderen Atomen und zur Bildung von Molekülen zur Verfügung stehen.
Sie könnten daran interessiert sein, Elemente, Verbindungen und Gemische zu sehen.
Was ist ein Molekül??
Ein Molekül ist das Ergebnis der Vereinigung von zwei oder mehr Atomen. Elektronen, die sich in der äußersten Hülle eines Atoms befinden (Valenzelektronen), bilden ein Molekül, wenn sie zwischen Atomen geteilt werden.
Das Molekül ist der kleinste Teil einer Substanz. Moleküle aus zwei Atomen werden genannt zweiatomig, zum Beispiel die O.zwei molekularer Sauerstoff, Stickstoff aus Luft N.zwei und Chlorgas Clzwei.
Es gibt Moleküle, die aus Hunderten von Atomen bestehen. Beispielsweise besteht das Chlorophyllmolekül aus 55 Kohlenstoffatomen, 72 Wasserstoffatomen, einem Magnesiumatom, 4 Stickstoffatomen und 5 Sauerstoffatomen mit insgesamt 137 Atomen..
Beispiele für Moleküle
Im Universum gibt es unendlich viele Moleküle, von denen wir nur einige erwähnen.
H.zwei zweiatomiger Wasserstoff
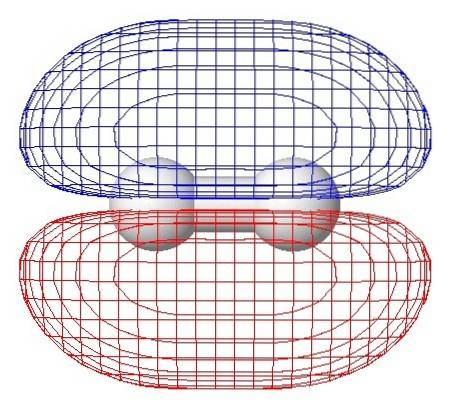
Das einfachste Molekül ist zweiatomiger Wasserstoff H.zwei, gebildet durch zwei Wasserstoffatome, die durch eine kovalente Bindung verbunden sind, wobei Elektronen zwischen den beiden Atomen geteilt werden.
Wasser
Wasser H.zweiO ist ein triatomisches Molekül, da es aus drei Atomen besteht. Seine besondere strukturelle Konformation verleiht ihm einen dipolaren Charakter mit einer negativen Teilladung am Sauerstoffende und zwei positiven Teilladungen an den Wasserstoffatomen..
Glucose
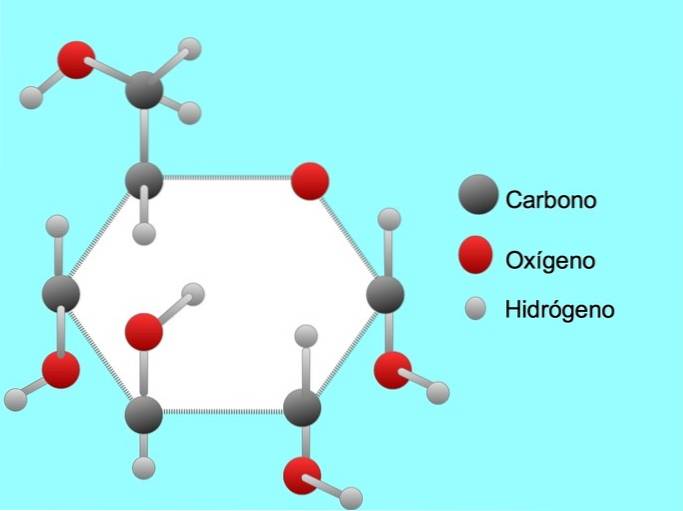
Glukose ist eine Art Zucker. Das Zuckermolekül enthält sechs Kohlenstoffatome, zwölf Wasserstoffatome und sechs Sauerstoffatome..
Sie könnten interessiert sein zu sehen:
- Arten chemischer Bindungen.
- Materiezustände und Eigenschaften der Materie.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.