
Möge Grünwald-Giemsa Begründung, Technik und Verwendung färben

Das Möge Grünwald-Giemsa färben o Pappenheim ist eine Differenzialfärbetechnik, bei der Giemsa- und May Grünwald-Reagenzien gemischt werden. Es wird zur Unterscheidung normaler und abnormaler Blutzellen in peripheren Blut- und Knochenmarkabstrichen sowie zur Färbung von histologischen Schnitten und zytologischen Proben verwendet..
Beide Reagenzien - Giemsa und May Grünwald - stammen aus der Färbung vom Romanowsky-Typ, einer Technik, die auf der Kombination von sauren und basischen Farbstoffen basiert..
Giemsa verbesserte die Technik durch Stabilisierung der Mischung aus Eosin, Methylenblau und ihren Derivaten mit Glycerin. Stattdessen verwendet May Grünwald Eosin und Methylenblau unter Verwendung von Methanol als Lösungsmittel. Diese strategische Kombination hat zu hervorragenden Ergebnissen geführt.
Obwohl es in Bezug auf die Beobachtung der Zellmorphologie ähnlich wie die Giemsa- und Wright-Färbungen wirkt, verbessert diese Technik die vorherigen, indem die Färbung der Parasiten, die Malaria, Chagas-Krankheit, Leishmaniose und Trichomoniasis verursachen, verfeinert wird..
Darüber hinaus hat es sich als sehr nützliche Technik für die zytologische Untersuchung von Samenflüssigkeit erwiesen. Es zeichnete sich nicht nur dadurch aus, dass es die morphologischen Eigenschaften von Spermatozoen zeigte, sondern auch die Differenzierung von Leukozyten, Epithelzellen und Spermatogenesezellen mit großer Effizienz ermöglichte..
Artikelverzeichnis
- 1 Begründung
- 1.1 Vielzahl von Farbstoffen
- 2 Technik
- 2.1 Materialien
- 2.2 Konzentrierte May Grünwald Farbstofflösung
- 2.3 Konzentrierte Giemsa-Färbung
- 2.4 Herstellung der Pufferlösung bei pH 7,2
- 2.5 Verfahren zur Färbung von Blut- oder Knochenmarkabstrichen
- 2.6 Technik zum Färben von Abstrichen von Spermienflüssigkeit
- 2.7 Wichtige Spezifikationen
- 3 Verwendungen
- 3.1 Vaginale Zytologie
- 3.2 Spermaprobe
- 4 Referenzen
Basis
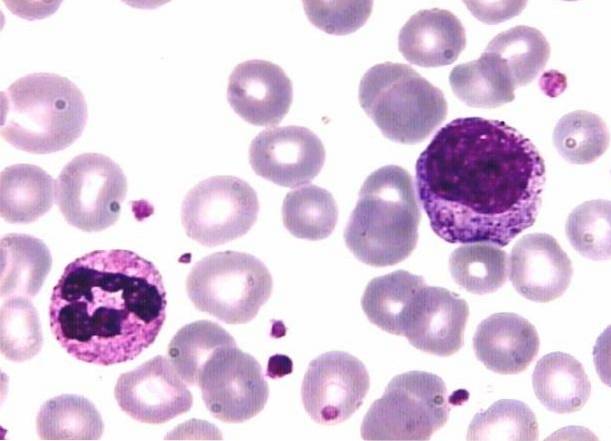
Die Technik folgt der Grundlage von Romanowsky-Färbungen, bei denen saure Farbstoffe eine selektive Affinität zu basischen Zellkomponenten aufweisen und saure Komponenten basische Färbungen anziehen..
Auf andere Weise erklärt, haben sowohl Zellstrukturen als auch Farbstoffe positive oder negative elektrische Ladungen; wie Ladungen abstoßen und verschiedene Ladungen anziehen.
Beispielsweise sind basische Farbstoffe wie Methylenblau positiv geladen und werden von negativ geladenen Strukturen angezogen. Deshalb färbt dieser Farbstoff DNA- und RNA-reiche Kerne mit negativ geladenen Phosphatgruppen..
Das Granulat segmentierter Basophiler und die Zytoplasmen mononukleärer weißer Blutkörperchen, die RNA enthalten, werden ebenfalls gefärbt..
Ebenso trägt der Säurefarbstoff eine negative Ladung, weshalb er an positiv geladene Strukturen wie Erythrozyten und Granulate segmentierter Eosinophiler bindet. Das Granulat der segmentierten Neutrophilen fixiert beide Farbstoffe.
Vielzahl von Farbstoffen
Bei dieser Technik besteht eine Kombination von Reaktionen zwischen orthochromatischen und metachromatischen Farbstoffen. Orthochromatika (Eosin und Methylenblau) binden an die Zellstruktur, mit der sie verwandt sind, und liefern eine stabile Farbe, die nicht variiert.
Andererseits variieren Metachromatika (die Derivate von Methylenblau-Azurblau A und Azurblau B) ihre ursprüngliche Farbe, sobald sie an die spezifische Struktur gebunden sind, und es kann sogar eine Vielzahl von Farbtönen geben.
Schließlich erfordert der Schritt, den die May Grünwald-Lösung unternimmt, die Anwesenheit von Wasser, da der Farbstoff ohne diesen die Strukturen durchdringt, aber nicht aushärtet. Dazu muss der Farbstoff polar werden oder ionisieren und somit ausfallen und an verwandte Strukturen binden können..
Technik
Materialien
- Mikroskopische Objektträger.
- Brücken der Färbung.
- May-Grünwald-Lösung.
- Giemsa-Fleck.
- Destilliertes Wasser.
Möge Grünwald konzentrierte Lösung färben
0,25 g Eosin-Methylenblau (Färbung nach May Grünwald) sollten abgewogen und in 100 ml Methanol gelöst werden. Dann wird das Präparat 1 Stunde lang gemischt und 24 Stunden lang ruhen gelassen. Wenn die Zeit abgelaufen ist, leckt es.
Um die Technik anzuwenden, muss der May Grünwald-Farbstoff wie folgt verdünnt werden: Für 200 ml verdünnten Farbstoff 30 ml der konzentrierten Lösung messen, 20 ml Pufferlösung und 150 ml destilliertes Wasser hinzufügen, eingestellt auf pH 7,2-7,3. Später wird es gemischt und gefiltert.
Giemsa Fleckkonzentrat
0,5 g Azur-Eosin-Methylenblau (Färbung nach Giemsa) müssen gewogen, in 50 ml Methanol gelöst und 50 ml Glycerin zu der Mischung gegeben werden.
Um die Technik durchzuführen, wird sie 1:10 mit Pufferlösung verdünnt und 10 Minuten stehen gelassen. Kann bei Bedarf gefiltert werden.
Herstellung der Pufferlösung bei pH 7,2
Sie sollten gewogen werden:
- 40 mg Kaliumdihydrogenphosphat (KH2PO4).
- 151 mg Dinatriumhydrogenphosphat 12-Hydrat (Na2HPO4).
Beide Verbindungen werden in 100 ml Wasser gelöst.
Verfahren zur Färbung von Blut- oder Knochenmarkabstrichen
Es gibt zwei Modi: einen klassischen und einen schnellen.
Klassischer Modus
- Decken Sie die Abstriche 2 bis 3 Minuten lang mit der verdünnten May-Grünwald-Lösung ab..
- Mit gepuffertem destilliertem Wasser waschen, um die vorherige Lösung zu entfernen.
- Mit der gleichen gepufferten Waschlösung abdecken und 1 Minute ruhen lassen. Die Idee ist, dass der vorherige Farbstoff an den Strukturen fixiert ist und gleichzeitig die Zellen hydratisiert werden.
- 12 Tropfen verdünnte Giemsa-Tinktur in das gepufferte Wasser geben und zum Mischen und Homogenisieren blasen. 15-20 Minuten stehen lassen.
- Abstriche mit gepuffertem destilliertem Wasser waschen und an der Luft trocknen lassen.
- Fokussieren und beobachten Sie die gefärbten Blutzellen unter einem Lichtmikroskop mit dem 40X-Objektiv. Bei Bedarf kann der 100X verwendet werden.
Schneller Modus
- Decken Sie den Abstrich 1 Minute lang mit verdünntem May Grünwald-Fleck ab..
- Mit gepuffertem destilliertem Wasser waschen.
- Mit gepuffertem Wasser abdecken und 1 Minute stehen lassen.
- Legen Sie den verdünnten Giemsa-Fleck und lassen Sie ihn 5 Minuten einwirken.
- Mit gepuffertem destilliertem Wasser waschen und an der Luft trocknen lassen.
Die hier beschriebenen Techniken sind eine Richtlinie, es sollte jedoch berücksichtigt werden, dass die Verfahren und Färbezeiten je nach Handelsunternehmen, das die Reagenzien vertreibt, variieren. Es ist ratsam, die von jedem Geschäftshaus streng angegebenen Schritte zu befolgen.
Technik zum Färben von Abstrichen von Samenflüssigkeit
1- Decken Sie den Abstrich 4 Minuten lang mit einer dünnen Schicht der May Grünwald-Lösung ab.
2- Entfernen Sie den Farbstoff und waschen Sie ihn mit destilliertem Wasser.
3- Legen Sie eine Schicht verdünnten Giemsa (1:10) für 15 Minuten in destilliertes Wasser.
4- Entfernen Sie den Farbstoff und waschen Sie ihn mit destilliertem Wasser.
5- Trocknen lassen und im Mikroskop beobachten.
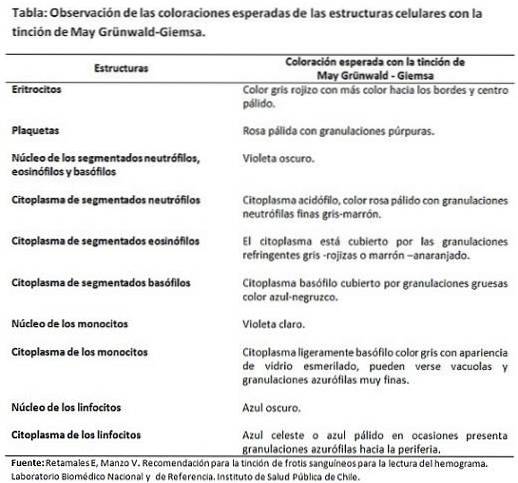
Wichtige Spezifikationen
Die Technik erfordert, dass die Reagenzien und die Waschlösungen einen auf 7,2 bis 7,3 eingestellten pH-Wert aufweisen, damit die Affinitäten der Farbstoffe für die Zellstrukturen nicht verzerrt werden und die erwartete Endfarbe nicht variiert..
Anwendungen
Diese Technik wird von klinischen Labors verwendet, um periphere Blut- und Knochenmarkabstriche, Gewebeschnitte und Zytologien zu färben..
Im hämatologischen Bereich ist diese Technik von entscheidender Bedeutung für die Untersuchung von Anomalien von Zellen in Bezug auf Form, Größe und Anzahl. Es ist ein sehr wertvolles Instrument zur Diagnose bestimmter Krankheiten wie Leukämien und Anämien.
Darüber hinaus ist es von hervorragendem Nutzen bei der Suche nach Parasiten in hämatologischen Gebieten (Plasmodium sp Y. Trypanosom Cruzi) oder histologisch (Leishmanias sp).
Vaginale Zytologie
In Bezug auf die vaginale Zytologie ist diese Technik besonders vorteilhaft für die Beobachtung von Trichomonas vaginalis. Dies ist ein wichtiger Befund, da seine Anwesenheit Bilder von Karzinomen simuliert. vor Ort die dann verschwinden, wenn der Parasit entfernt wird.
Spermaprobe
Es war ein ideales Werkzeug für die Untersuchung von Spermienproben, da es wertvolle Informationen über die Qualität der Spermien liefert.
Die angebotenen Daten haben hauptsächlich mit Anzahl und Morphologie sowie mit den möglicherweise vorhandenen und von entscheidender Bedeutung befindlichen Begleitzellen wie Keimzellen, Leukozyten und Epithelzellen zu tun..
Mit dieser Analyse ist es möglich, Anomalien zu beschreiben, die in den Spermien in Kopf, Hals, Mittelstück und Hauptteil beobachtet werden..
Darüber hinaus können sie auch dazu beitragen, Fälle von Hämospermie (Vorhandensein roter Blutkörperchen im Sperma) und Leukospermie oder Piospermie (erhöhte Anzahl von Leukozyten im Sperma) aufzuzeigen..
Verweise
- Costamagna S, Prado M. Validierung des frischen Tests, May Grünwald-Giemsa- und Gram-Färbungen und Kulturmedien zur Diagnose von Trichomonas vaginalis. Parasitol. 2001; 25 (1-2): 60-64. Erhältlich in: scielo.
- Merck KGaA Labor. Mai Grünwald Eosin Methylenblau für die Mikroskopie.
- "May-Grünwald-Giemsa-Fleck." Wikipedia, die freie Enzyklopädie. 15. November 2018, 14:37 UTC. 8. Januar 2019, 04:29 Uhr: en.wikipedia.org
- Panreac-Labor für Glaschemikalien. Reagenzien für histologische Techniken, Hämatologie und Mikrobiologie. Verfügbar unter: glasschemicals.com
- Retamales E, Manzo V. Empfehlung zur Färbung von Blutausstrichen zum Ablesen des Hämogramms. Nationales und biomedizinisches Referenzlabor. Institut für öffentliche Gesundheit von Chile.
- Sarabia L. Spermiogramm nach WHO-Kriterien. Programm für Entwicklungsanatomie und Biologie. Medizinische Fakultät. Universität von Chile. Verfügbar unter: pp.centramerica.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.