
Lösungsprozess, Unterschiede bei der Hydratation und Beispiele

Das Solvatation ist die physikalische und chemische Bindung zwischen gelösten und Lösungsmittelpartikeln in einer Lösung. Es unterscheidet sich vom Löslichkeitskonzept dadurch, dass zwischen einem Feststoff und seinen gelösten Partikeln kein thermodynamisches Gleichgewicht besteht..
Diese Vereinigung ist dafür verantwortlich, dass die gelösten Feststoffe im Hinblick auf die Zuschauer "verschwinden"; In der Realität werden die Partikel sehr klein und werden von Schichten aus Lösungsmittelmolekülen „bedeckt“, was es unmöglich macht, sie zu beobachten.
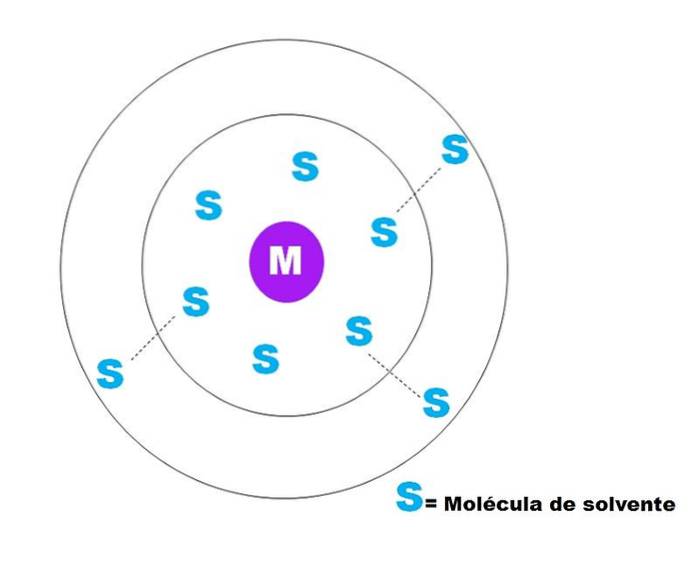
Eine sehr allgemeine Skizze der Solvatisierung eines Teilchens M ist im obigen Bild dargestellt. M kann durchaus ein Ion sein (M.+) oder ein Molekül; und S ist das Lösungsmittelmolekül, das jede Verbindung in flüssigem Zustand sein kann (obwohl es auch gasförmig sein kann).
Es ist zu beachten, dass M von sechs Molekülen von S umgeben ist, die das bilden, was als bekannt ist primäre Solvatationskugel. Andere S-Moleküle in größerer Entfernung interagieren durch Van-der-Waals-Kräfte mit den ersteren und bilden eine Kugel der sekundären Solvatation usw., bis eine gewisse Sortierung nicht mehr erkennbar ist..
Artikelverzeichnis
- 1 Lösungsprozess
- 2 Energieaspekte
- 3 Intermolekulare Wechselwirkungen
- 4 Unterschiede bei der Flüssigkeitszufuhr
- 5 Beispiele
- 5.1 Calciumchlorid
- 5.2 Harnstoff
- 5.3 Ammoniumnitrat
- 6 Referenzen
Lösungsprozess
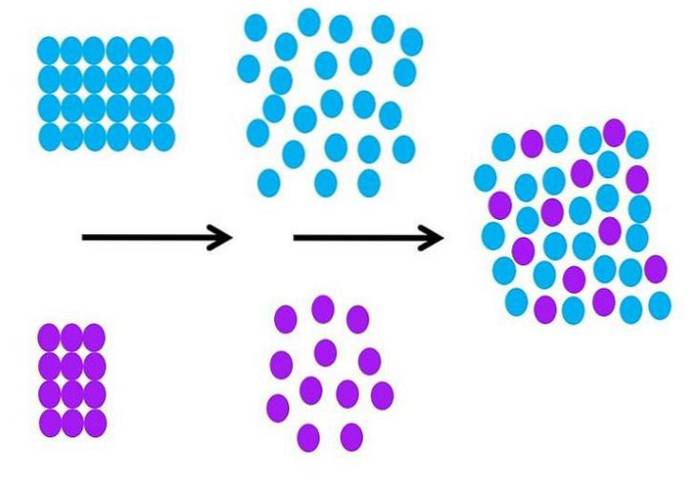
Wie ist der Solvatationsprozess molekular? Das Bild oben fasst die notwendigen Schritte zusammen.
Die blau gefärbten Lösungsmittelmoleküle sind zunächst geordnet und interagieren alle miteinander (S-S). und lila gelöste Partikel (Ionen oder Moleküle) tun dasselbe mit starken oder schwachen M-M-Wechselwirkungen.
Damit eine Solvatisierung stattfinden kann, müssen sich sowohl das Lösungsmittel als auch der gelöste Stoff ausdehnen (zweiter schwarzer Pfeil), um Wechselwirkungen zwischen gelöstem Stoff und Lösungsmittel (M-S) zu ermöglichen..
Dies impliziert notwendigerweise eine Abnahme der Wechselwirkungen zwischen gelöstem Stoff und Lösungsmittel und Lösungsmittel; Abnahme, die Energie benötigt, und daher ist dieser erste Schritt endotherm.
Sobald sich der gelöste Stoff und das Lösungsmittel molekular ausgedehnt haben, mischen sich die beiden und tauschen sie im Raum aus. Jeder violette Kreis im zweiten Bild kann mit dem im ersten Bild verglichen werden.
Eine Änderung des Ordnungsgrades der Partikel kann im Bild detailliert dargestellt werden; am Anfang bestellt und am Ende ungeordnet. Infolgedessen ist der letzte Schritt exotherm, da die Bildung der neuen M-S-Wechselwirkungen alle Partikel in der Lösung stabilisiert..
Energieaspekte
Hinter dem Solvatisierungsprozess stehen viele energetische Aspekte, die berücksichtigt werden müssen. Erstens: S-S-, M-M- und M-S-Wechselwirkungen.
Wenn die M-S-Wechselwirkungen, dh zwischen dem gelösten Stoff und dem Lösungsmittel, im Vergleich zu denen der einzelnen Komponenten viel höher (stark und stabil) sind, sprechen wir von einem exothermen Solvatisierungsprozess; und daher wird Energie an das Medium abgegeben, was durch Messen des Temperaturanstiegs mit einem Thermometer überprüft werden kann.
Wenn im Gegenteil die M-M- und S-S-Wechselwirkungen stärker sind als die M-S-Wechselwirkungen, benötigen sie zum „Ausdehnen“ mehr Energie als sie gewinnen, wenn die Solvatisierung abgeschlossen ist..
Man spricht dann von einem endothermen Solvatisierungsprozess. In diesem Fall wird ein Temperaturabfall aufgezeichnet oder die Umgebung wird gekühlt.
Es gibt zwei grundlegende Faktoren, die bestimmen, ob sich ein gelöster Stoff in einem Lösungsmittel löst oder nicht. Die erste ist die Enthalpieänderung der Lösung (ΔHdis), wie gerade erläutert, und die zweite ist die Entropieänderung (ΔS) zwischen dem gelösten Stoff und dem gelösten gelösten Stoff. Im Allgemeinen ist ΔS mit der ebenfalls oben erwähnten Zunahme der Störung verbunden.
Intermolekulare Wechselwirkungen
Es wurde erwähnt, dass die Solvatisierung das Ergebnis der physikalischen und chemischen Bindung zwischen dem gelösten Stoff und dem Lösungsmittel ist; Wie genau sind diese Interaktionen oder Gewerkschaften??
Wenn der gelöste Stoff ein Ion ist, ist M.+, es treten sogenannte Ionen-Dipol-Wechselwirkungen auf (M.+-S); und wenn es sich um ein Molekül handelt, kommt es zu Dipol-Dipol-Wechselwirkungen oder Londoner Streukräften.
Wenn man über Dipol-Dipol-Wechselwirkungen spricht, wird gesagt, dass es in M und S ein permanentes Dipolmoment gibt. Somit interagiert der δ-elektronenreiche Bereich von M mit dem δ + -elektronenarmen Bereich von S. Das Ergebnis Von all diesen Wechselwirkungen ist die Bildung mehrerer Solvatationskugeln um M..
Zusätzlich gibt es eine andere Art der Interaktion: die koordinative. Hier bilden die S-Moleküle Koordinationsbindungen (oder Dativbindungen) mit M und bilden verschiedene Geometrien.
Eine grundlegende Regel zum Auswendiglernen und Vorhersagen der Affinität zwischen dem gelösten Stoff und dem Lösungsmittel lautet: gleich löst gleich auf. Daher lösen sich polare Substanzen sehr leicht in gleichpolaren Lösungsmitteln; und unpolare Substanzen lösen sich in unpolaren Lösungsmitteln.
Unterschiede bei der Flüssigkeitszufuhr
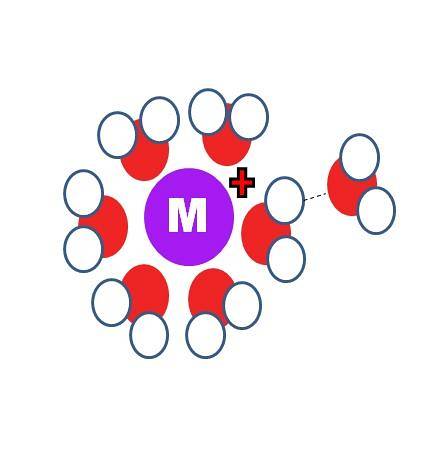
Wie unterscheidet sich die Solvatation von der Hydratation? Die beiden identischen Prozesse, außer dass die S-Moleküle im ersten Bild durch die von Wasser, H-O-H, ersetzt werden.
Im oberen Bild sehen Sie ein Kation M.+ umgeben von sechs H-MolekülenzweiO. Beachten Sie, dass die Sauerstoffatome (rot gefärbt) auf die positive Ladung gerichtet sind, da sie am elektronegativsten ist und daher die höchste negative Dichte δ aufweist-.
Hinter der ersten Hydratationskugel sind andere Wassermoleküle durch Wasserstoffbrücken (OH) gruppiertzwei-Ohzwei). Dies sind Ionen-Dipol-Wechselwirkungen. Wassermoleküle können jedoch auch Koordinationsbindungen mit dem positiven Zentrum eingehen, insbesondere wenn es metallisch ist..
So sind die berühmten Aquakomplexe M (OHzwei)n. Da im Bild n = 6 ist, sind die sechs Moleküle in einem Koordinationsoktaeder (der inneren Hydratationssphäre) um M orientiert. Abhängig von der Größe von M.+, Aufgrund der Größe seiner Ladung und seiner elektronischen Verfügbarkeit kann diese Kugel kleiner oder größer sein.
Wasser ist vielleicht das überraschendste Lösungsmittel von allen: Es löst eine unermessliche Menge an gelösten Stoffen auf, ist ein zu polares Lösungsmittel und hat eine ungewöhnlich hohe Dielektrizitätskonstante (78,5 K)..
Beispiele
Drei Beispiele für die Solvatisierung in Wasser sind nachstehend aufgeführt.
Calciumchlorid
Das Auflösen von Calciumchlorid in Wasser setzt Wärme frei, wenn Ca-Kationen solvatisieren.zwei+ und Cl-Anionen-. Die ca.zwei+ umgibt sich mit einer Anzahl von Wassermolekülen gleich oder größer als sechs (Ca.zwei+-Ohzwei).
Ebenso ist die Cl- ist von Wasserstoffatomen umgeben, der δ + -Region von Wasser (Cl--H.zweiODER). Die freigesetzte Wärme kann zum Schmelzen von Eismassen verwendet werden.
Harnstoff
Bei Harnstoff handelt es sich um ein organisches Molekül mit der Struktur H.zweiN-CO-NHzwei. Bei der Solvatisierung die H-MolekülezweiOder es bildet Wasserstoffbrücken mit den beiden Aminogruppen (-NH)zwei-Ohzwei) und mit der Carbonylgruppe (C = O-HzweiODER). Diese Wechselwirkungen sind für die große Löslichkeit in Wasser verantwortlich..
Ebenso ist seine Auflösung endotherm, dh es kühlt den Wasserbehälter, in dem es hinzugefügt wird.
Ammoniumnitrat
Ammoniumnitrat ist wie Harnstoff ein gelöster Stoff, der die Lösung nach der Solvatisierung ihrer Ionen abkühlt. NH4+ wird ähnlich wie Ca solvatisiertzwei+, obwohl es wahrscheinlich, weil es eine tetraedrische Geometrie hat, weniger H-Moleküle hatzweiOder um dich herum; und die NO3- wird auf die gleiche Weise wie Cl-Anionen solvatisiert- (OHzwei-ODERzweiNO-HzweiODER).
Verweise
- Glasstone S. (1970). Abhandlung über Chemie und Physik. Aguilar, S. A., Madrid, Spanien.
- Whitten, Davis, Peck & Stanley. Chemie. (8. Aufl.). CENGAGE Lernen.
- Ira N. Levine. (2014). Prinzipien der Physikochemie. Sechste Ausgabe. Mc Graw Hill.
- Chemicool Wörterbuch. (2017). Definition der Lösung. Wiederhergestellt von: chemicool.com
- Belford R. (s.f.). Lösungsprozesse. Chemie LibreTexts. Wiederhergestellt von: chem.libretexts.org
- Wikipedia. (2018). Lösung. Wiederhergestellt von: en.wikipedia.org
- Hardinger A. Steven. (2017). Illustriertes Glossar der Organischen Chemie: Lösung. Wiederhergestellt von: chem.ucla.edu
- Surf Guppy. (s.f.). Der Prozess der Lösung. Wiederhergestellt von: surfguppy.com

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.