
Chemische Bindungseigenschaften, wie sie gebildet werden, Typen
Das Chemische Bindung Es ist die Kraft, die es schafft, die Atome, aus denen die Materie besteht, zusammenzuhalten. Jede Art von Materie hat eine charakteristische chemische Bindung, die aus der Beteiligung eines oder mehrerer Elektronen besteht. So unterscheiden sich die Kräfte, die Atome in Gasen vereinen, beispielsweise von Metallen.
Alle Elemente des Periodensystems (mit Ausnahme von Helium und den leichten Edelgasen) können chemische Bindungen miteinander eingehen. Die Art dieser Elemente hängt jedoch davon ab, von welchen Elementen die Elektronen stammen, aus denen sie bestehen. Ein wesentlicher Parameter zur Erklärung der Art der Bindungen ist die Elektronegativität.
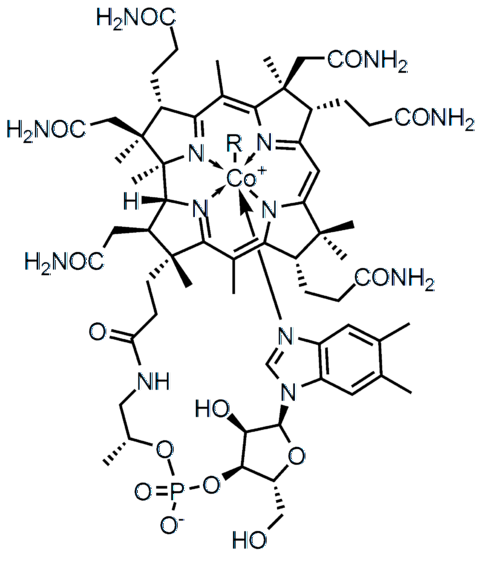
Der Unterschied in der Elektronegativität (ΔE) zwischen zwei Atomen definiert nicht nur die Art der chemischen Bindung, sondern auch die physikochemischen Eigenschaften der Verbindung. Die Salze zeichnen sich durch Ionenbindungen (hohes ΔE) und viele der organischen Verbindungen wie Vitamin B aus12 (oberes Bild), kovalente Bindungen (ΔE niedrig).
In der höhermolekularen Struktur repräsentiert jede der Linien eine kovalente Bindung. Die Keile zeigen an, dass die Verbindung aus der Ebene (in Richtung des Lesers) und die unterstrichenen hinter der Ebene (vom Leser weg) austritt. Beachten Sie, dass es Doppelbindungen (=) und ein Kobaltatom gibt koordiniert mit fünf Stickstoffatomen und einer R-Seitenkette.
Aber warum bilden sich solche chemischen Bindungen? Die Antwort liegt in der energetischen Stabilität der beteiligten Atome und Elektronen. Diese Stabilität muss die elektrostatischen Abstoßungen zwischen Elektronenwolken und Kernen und die Anziehungskraft, die ein Kern auf die Elektronen des benachbarten Atoms ausübt, ausgleichen..
Artikelverzeichnis
- 1 Definition der chemischen Bindung
- 2 Funktionen
- 3 Wie entstehen chemische Bindungen??
- 3.1 Homonukleare Verbindungen A-A
- 3.2 Heteronukleare Verbindungen A-B
- 4 Arten chemischer Bindungen
- 4.1-Kovalente Bindung
- 4.2-Ionenbindung
- 4.3 Metallbindung
- 5 Beispiele für Links
- 6 Bedeutung der chemischen Bindung
- 7 Referenzen
Definition der chemischen Bindung
Viele Autoren haben Definitionen der chemischen Bindung gegeben. Von all diesen war das wichtigste das des Physikochemikers G. N. Lewis, der die chemische Bindung als Beteiligung eines Elektronenpaares zwischen zwei Atomen definierte. Wenn die Atome A und B ein einzelnes Elektron beitragen können, bildet sich zwischen ihnen die Einfachbindung A: B oder A-B.
Vor der Bindungsbildung sind sowohl A als auch B durch einen unbestimmten Abstand getrennt, aber beim Binden gibt es jetzt eine Kraft, die sie in der zweiatomigen Verbindung AB zusammenhält, und einen Bindungsabstand (oder eine Bindungslänge)..
Eigenschaften
Was sind die Eigenschaften dieser Kraft, die die Atome zusammenhält? Diese hängen mehr von der Art der Verbindung zwischen A und B ab als von ihren elektronischen Strukturen. Zum Beispiel ist die A-B-Verbindung gerichtet. Was bedeutet das? Dass die durch die Vereinigung des Elektronenpaars ausgeübte Kraft auf einer Achse dargestellt werden kann (als wäre es ein Zylinder).
Auch diese Bindung benötigt Energie, um zu brechen. Diese Energiemenge kann in Einheiten von kJ / mol oder cal / mol ausgedrückt werden. Sobald genügend Energie an die Verbindung AB angelegt wurde (z. B. durch Wärme), dissoziiert sie in die ursprünglichen A- und B-Atome..
Je stabiler die Bindung ist, desto mehr Energie wird benötigt, um die gebundenen Atome zu trennen..
Wenn andererseits die Bindung in Verbindung AB ionisch wäre, wäre A.+B.-, dann wäre es eine ungerichtete Kraft. Warum? weil+ übt eine anziehende Kraft auf B aus- (und umgekehrt), die mehr von der Entfernung abhängt, die beide Ionen im Raum trennt, als von ihrer relativen Position.
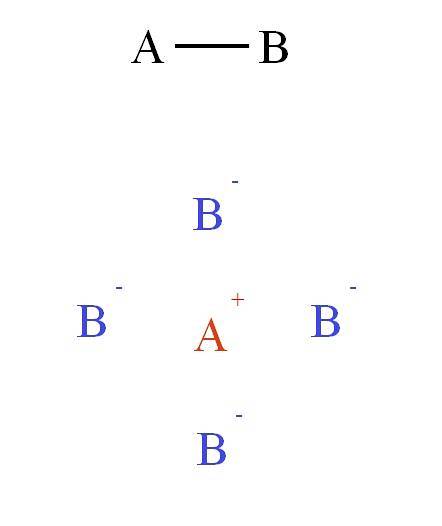
Dieses Feld der Anziehung und Abstoßung bringt andere Ionen zusammen, um das sogenannte Kristallgitter zu bilden (oberes Bild: Kation A.+ liegt umgeben von vier Anionen B.-, und diese vier Kationen A.+ und so weiter).
Wie entstehen chemische Bindungen??
Homonukleare Verbindungen A-A
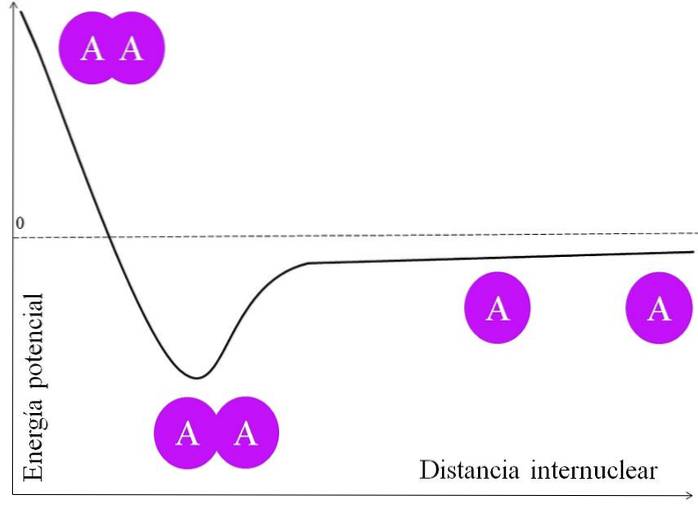
Damit ein Elektronenpaar eine Bindung eingeht, müssen viele Dinge zuerst berücksichtigt werden. Die Kerne, um die von A zu sagen, haben Protonen und sind daher positiv. Wenn zwei A-Atome sehr weit voneinander entfernt sind, dh in einem großen Abstand zwischen den Kernen (oberes Bild), erfahren sie keine Anziehung.
Wenn sich die beiden A-Atome ihren Kernen nähern, ziehen sie die Elektronenwolke des benachbarten Atoms (den violetten Kreis) an. Dies ist die Anziehungskraft (A auf dem benachbarten violetten Kreis). Die beiden Kerne von A stoßen sich jedoch gegenseitig ab, weil sie positiv sind, und diese Kraft erhöht die potentielle Energie der Bindung (vertikale Achse)..
Es gibt eine internukleare Distanz, in der die potentielle Energie ein Minimum erreicht; Das heißt, sowohl die Anziehungskraft als auch die Abstoßungskraft sind ausgeglichen (die beiden A-Atome im unteren Teil des Bildes)..
Wenn dieser Abstand nach diesem Punkt abnimmt, bewirkt die Bindung, dass sich die beiden Kerne mit großer Kraft abstoßen, wodurch die A-A-Verbindung destabilisiert wird..
Damit sich die Bindung bilden kann, muss ein energetisch angemessener Abstand zwischen den Kernen vorhanden sein. und außerdem müssen sich die Atomorbitale korrekt überlappen, damit sich die Elektronen verbinden können.
Heteronukleare Verbindungen A-B
Was wäre, wenn sich anstelle von zwei Atomen von A eines von A und das andere von B verbinden würde? In diesem Fall würde sich der obere Graph ändern, da eines der Atome mehr Protonen als das andere hätte und die Elektronenwolken unterschiedliche Größen hätten..
Da die A-B-Bindung im geeigneten Abstand zwischen den Kernen gebildet wird, befindet sich das Elektronenpaar hauptsächlich in der Nähe des elektronegativsten Atoms. Dies ist bei allen heteronuklearen chemischen Verbindungen der Fall, die die überwiegende Mehrheit der bekannten (und bekannten) Verbindungen ausmachen..
Obwohl nicht ausführlich erwähnt, gibt es zahlreiche Variablen, die die Annäherung von Atomen und die Bildung chemischer Bindungen direkt beeinflussen. Einige sind thermodynamisch (ist die Reaktion spontan?), elektronisch (wie voll oder leer sind die Orbitale der Atome) und andere kinetisch.
Arten chemischer Bindungen
Links weisen eine Reihe von Merkmalen auf, die sie voneinander unterscheiden. Einige von ihnen können in drei Hauptklassifikationen eingeteilt werden: kovalent, ionisch oder metallisch.
Obwohl es Verbindungen gibt, deren Bindungen zu einem einzigen Typ gehören, bestehen viele tatsächlich aus einer Mischung von Zeichen von jedem. Diese Tatsache ist auf den Unterschied in der Elektronegativität zwischen den Atomen zurückzuführen, die die Bindungen bilden. Daher können einige Verbindungen kovalent sein, haben jedoch einen bestimmten ionischen Charakter in ihren Bindungen..
Ebenso sind die Art der Bindung, die Struktur und die Molekülmasse Schlüsselfaktoren, die die makroskopischen Eigenschaften der Materie definieren (Helligkeit, Härte, Löslichkeit, Schmelzpunkt usw.)..
-Kovalente Bindung
Kovalente Bindungen sind diejenigen, die bisher erklärt wurden. In ihnen müssen sich zwei Orbitale (jeweils ein Elektron) mit den Kernen überlappen, die in einem angemessenen Abstand zwischen den Kernen voneinander getrennt sind..
Nach der Molekülorbitaltheorie (TOM) bildet sich bei einer frontalen Überlappung der Orbitale eine Sigma-σ-Bindung (die auch als einfache oder einfache Bindung bezeichnet wird). Wenn die Orbitale durch laterale und senkrechte Überlappungen in Bezug auf die Kernachse gebildet werden, haben wir die π-Bindungen (Doppel- und Dreifachbindungen):
Einfacher Link
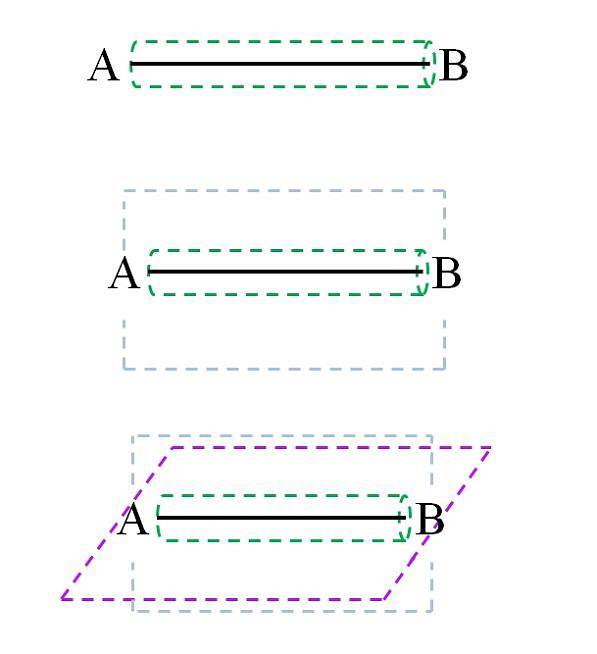
Die σ-Bindung wird, wie im Bild zu sehen ist, entlang der Kernachse gebildet. Obwohl nicht gezeigt, können A und B andere Bindungen und daher ihre eigene chemische Umgebung (verschiedene Teile der Molekülstruktur) aufweisen. Diese Art von Verbindung zeichnet sich durch ihre Drehkraft (grüner Zylinder) aus und ist die stärkste von allen.
Beispielsweise kann sich die Einfachbindung im Wasserstoffmolekül um die internukleare (H-H) Achse drehen. Ebenso kann ein hypothetisches Molekül CA-AB dies tun..
Die Verbindungen C-A, A-A und A-B drehen sich. Wenn jedoch C oder B Atome oder eine Gruppe sperriger Atome sind, wird die A-A-Rotation sterisch behindert (weil C und B kollidieren würden)..
Einfachbindungen finden sich in praktisch allen Molekülen. Ihre Atome können jede chemische Hybridisierung aufweisen, solange die Überlappung ihrer Orbitale frontal ist. Zurück zur Struktur von Vitamin B.12, Jede einzelne Zeile (-) gibt einen einzelnen Link an (z. B. -CONH-Linkszwei).
Doppelverbindung
Die Doppelbindung erfordert, dass die Atome (normalerweise) eine sp-Hybridisierung aufweisenzwei. Die reine p-Bindung senkrecht zu den drei hybriden sp-Orbitalenzwei, bildet die Doppelbindung, die als graues Blatt erscheint.
Beachten Sie, dass sowohl die Einfachbindung (grüner Zylinder) als auch die Doppelbindung (graues Blatt) gleichzeitig existieren. Im Gegensatz zu Einfachbindungen haben Doppelbindungen jedoch nicht die gleiche Rotationsfreiheit um die Kernachse. Dies liegt daran, dass zum Drehen die Verbindung (oder die Folie) brechen muss. Prozess, der Energie benötigt.
Außerdem ist die A = B-Bindung reaktiver als A-B. Seine Länge ist kürzer und die Atome A und B befinden sich in einem kürzeren Abstand zwischen den Kernen. daher gibt es eine größere Abstoßung zwischen beiden Kernen. Das Aufbrechen sowohl der Einfach- als auch der Doppelbindung erfordert mehr Energie als zur Trennung der Atome im A-B-Molekül erforderlich ist..
In der Struktur von Vitamin B.12 Es können mehrere Doppelbindungen beobachtet werden: C = O, P = O und innerhalb der aromatischen Ringe.
Dreifachbindung
Die Dreifachbindung ist noch kürzer als die Doppelbindung und ihre Rotation wird energetisch behindert. Darin werden zwei senkrechte π-Bindungen (die graue und violette Schicht) sowie eine Einfachbindung gebildet.
Normalerweise muss die chemische Hybridisierung der Atome von A und B sp sein: zwei sp-Orbitale im Abstand von 180 ° und zwei reine p-Orbitale senkrecht zum ersten. Beachten Sie, dass eine Dreifachbindung wie ein Paddel aussieht, jedoch ohne Rotationskraft. Diese Bindung kann einfach als A≡B (N≡N, Stickstoffmolekül N dargestellt werdenzwei).
Von allen kovalenten Bindungen ist dies die reaktivste; aber gleichzeitig derjenige, der mehr Energie für die vollständige Trennung seiner Atome benötigt (· A: +: B ·). Wenn Vitamin B.12 hatte eine Dreifachbindung innerhalb seiner Molekülstruktur, würde sich seine pharmakologische Wirkung drastisch ändern.
Sechs Elektronen sind an Dreifachbindungen beteiligt; im Doppel vier Elektronen; und im Einfachen oder Einfachen zwei.
Die Bildung einer oder mehrerer dieser kovalenten Bindungen hängt von der elektronischen Verfügbarkeit der Atome ab; Das heißt, wie viele Elektronen benötigen ihre Orbitale, um ein Oktett der Valenz zu erhalten?.
Unpolare Bindung
Eine kovalente Bindung besteht aus einer gleichen Verteilung eines Elektronenpaars zwischen zwei Atomen. Dies gilt jedoch nur für den Fall, dass beide Atome gleiche Elektronegativitäten aufweisen. das heißt, die gleiche Tendenz, die Elektronendichte aus seiner Umgebung in ein Komposit zu ziehen.
Unpolare Bindungen sind durch eine Elektronegativitätsdifferenz von Null (ΔE≈0) gekennzeichnet. Dies tritt in zwei Situationen auf: in einer homonuklearen Verbindung (A.zwei) oder wenn die chemischen Umgebungen auf beiden Seiten der Bindung gleich sind (H.3C-CH3, Ethanmolekül).
Beispiele für unpolare Bindungen sind in den folgenden Verbindungen zu sehen:
-Wasserstoff (H-H)
-Sauerstoff (O = O)
-Stickstoff (N≡N)
-Fluor (F-F)
-Chlor (Cl-Cl)
-Acetylen (HC≡CH)
Polare Bindungen
Wenn zwischen beiden Atomen ein deutlicher Unterschied in der Elektronegativität ΔE besteht, wird entlang der Bindungsachse ein Dipolmoment gebildet: A.δ+-B.δ-. Im Fall der heteronuklearen Verbindung AB ist B das elektronegativste Atom und hat daher eine höhere Elektronendichte δ-; während A, der am wenigsten elektronegative, Ladungsmangel δ ist+.
Damit die polaren Bindungen auftreten können, müssen sich zwei Atome mit unterschiedlichen Elektronegativitäten verbinden. und bilden so heteronukleare Verbindungen. A-B ähnelt einem Magneten: Es hat einen positiven und einen negativen Pol. Dies ermöglicht es ihm, mit anderen Molekülen durch Dipol-Dipol-Kräfte zu interagieren, zu denen auch Wasserstoffbrücken gehören..
Wasser hat zwei polare kovalente Bindungen, H-O-H, und seine Molekülgeometrie ist eckig, was sein Dipolmoment erhöht. Wenn seine Geometrie linear wäre, würden die Ozeane verdampfen und das Wasser hätte einen niedrigeren Siedepunkt.
Die Tatsache, dass eine Verbindung polare Bindungen aufweist, bedeutet nicht, dass es polar ist. Zum Beispiel Tetrachlorkohlenstoff, CCl4, hat vier polare C-Cl-Bindungen, aber aufgrund ihrer tetraedrischen Anordnung wird das Dipolmoment vektoriell annulliert.
Dativ- oder Koordinationslinks
Wenn ein Atom ein Elektronenpaar aufgibt, um eine kovalente Bindung mit einem anderen Atom zu bilden, spricht man von einer Dativ- oder Koordinationsbindung. Zum Beispiel mit B: dem verfügbaren Elektronenpaar und A (oder A.+), eine elektronische Vakanz, wird die Verbindung B: A gebildet.
In der Struktur von Vitamin B.12 Die fünf Stickstoffatome sind durch diese Art der kovalenten Bindung an das Metallzentrum von Co gebunden. Diese Stickstoffatome geben ihr freies Elektronenpaar an das Co-Kation ab.3+, das Metall mit ihnen koordinieren (Co.3+: N-)
Ein weiteres Beispiel ist die Protonierung eines Ammoniakmoleküls zur Bildung von Ammoniak:
H.3N: + H.+ => NH4+
Beachten Sie, dass in beiden Fällen das Stickstoffatom die Elektronen beisteuert. Daher tritt die kovalente Dativ- oder Koordinationsbindung auf, wenn ein Atom allein das Elektronenpaar beisteuert.
Auf die gleiche Weise kann das Wassermolekül protoniert werden, um das Hydronium- (oder Oxonium-) Kation zu werden:
H.zweiO + H.+ => H.3ODER+
Im Gegensatz zum Ammoniumkation hat Hydronium immer noch ein freies Elektronenpaar (H.3ODER:+); Es ist jedoch sehr schwierig, ein anderes Proton zu akzeptieren, um die instabile Hydroniumdikation H zu bilden4ODERzwei+.
-Ionenverbindung

Abgebildet ist ein weißer Salzhügel. Die Salze zeichnen sich durch kristalline Strukturen aus, dh symmetrisch und geordnet; Hohe Schmelz- und Siedepunkte, hohe elektrische Leitfähigkeiten beim Schmelzen oder Auflösen sowie seine Ionen sind stark durch elektrostatische Wechselwirkungen gebunden.
Diese Wechselwirkungen bilden die sogenannte Ionenbindung. Im zweiten Bild wurde ein Kation A gezeigt+ umgeben von vier Anionen B.-, Dies ist jedoch eine 2D-Darstellung. In drei Dimensionen, A.+ sollte andere Anionen haben B.- vorwärts und hinter dem Flugzeug, bilden verschiedene Strukturen.
Somit ist A.+ Es kann sechs, acht oder sogar zwölf Nachbarn haben. Die Anzahl der Nachbarn, die ein Ion in einem Kristall umgeben, wird als Koordinationszahl (N.C.) bezeichnet. Für jede NC ist eine Art kristalline Anordnung zugeordnet, die wiederum eine feste Phase des Salzes darstellt.
Die symmetrischen und facettierten Kristalle in den Salzen sind auf das Gleichgewicht zurückzuführen, das durch die Anziehungswechselwirkungen hergestellt wird (A.+ B.-) und Abstoßung (A.+ ZU+, B.- B.-) elektrostatisch.
Ausbildung
Aber warum A + und B.-, oder Na+ und Cl-, keine kovalenten Na-Cl-Bindungen bilden? Denn das Chloratom ist viel elektronegativer als Natriummetall, das sich auch dadurch auszeichnet, dass es seine Elektronen sehr leicht abgibt. Wenn sich diese Elemente treffen, reagieren sie exotherm unter Bildung von Speisesalz:
2Na (s) + Clzwei(g) => 2NaCl (s)
Zwei Natriumatome geben ihr einwertiges Elektron (Na) an das zweiatomige Molekül von Cl abzwei, um die Cl-Anionen zu bilden-.
Die Wechselwirkungen zwischen Natriumkationen und Chloridanionen stellen, obwohl sie eine schwächere Bindung darstellen als kovalente, sie im Feststoff stark vereint; und diese Tatsache spiegelt sich im hohen Schmelzpunkt des Salzes (801ºC) wider..
Metallische Bindung

Die letzte Art der chemischen Bindung ist metallisch. Dies kann auf jedem Metall- oder Legierungsteil gefunden werden. Es zeichnet sich dadurch aus, dass es etwas Besonderes ist und sich von den anderen unterscheidet, da Elektronen nicht von einem Atom zum anderen gelangen, sondern sich wie ein Meer durch den Kristall der Metalle bewegen.
So vermischen metallische Atome, beispielsweise Kupfer, ihre Valenzorbitale miteinander, um Leitungsbänder zu bilden; durch die Elektronen (s, p, d oder f) die Atome passieren und sie fest zusammenhalten.
Abhängig von der Anzahl der Elektronen, die den Metallkristall passieren, den Orbitalen, die für die Bänder vorgesehen sind, und der Packung seiner Atome kann das Metall weich (wie Alkalimetalle), hart, glänzend oder ein guter elektrischer und heißer Leiter sein.
Die Kraft, die die Atome von Metallen zusammenhält, wie die, aus denen der kleine Mann auf dem Bild und sein Laptop bestehen, ist größer als die von Salzen.
Dies kann experimentell überprüft werden, da die Kristalle der Salze vor einer mechanischen Kraft in mehrere Hälften geteilt werden können; während ein Metallteil (bestehend aus sehr kleinen Kristallen) verformt wird.
Beispiele für Links
Die folgenden vier Verbindungen umfassen die Arten der erläuterten chemischen Bindungen:
-Natriumfluorid, NaF (Na+F.-): ionisch.
-Natrium, Na: metallisch.
-Fluor, F.zwei (F-F): unpolar kovalent, da zwischen beiden Atomen ein Null-ΔE besteht, weil sie identisch sind.
-Fluorwasserstoff, HF (H-F): polar kovalent, da Fluor in dieser Verbindung elektronegativer als Wasserstoff ist.
Es gibt Verbindungen wie Vitamin B.12, sowohl polare als auch ionische kovalente Bindungen besitzen (in der negativen Ladung seiner Phosphatgruppe -PO4--). In einigen komplexen Strukturen, wie z. B. Metallclustern, können alle diese Arten von Verbindungen sogar nebeneinander existieren.
Die Materie bietet in all ihren Erscheinungsformen Beispiele für chemische Bindungen. Vom Stein am Boden eines Teiches und dem Wasser, das ihn umgibt, bis zu den Kröten, die an seinen Rändern krächzen.
Obwohl die Bindungen einfach sein mögen, machen die Anzahl und räumliche Anordnung der Atome in der Molekülstruktur einer reichen Vielfalt von Verbindungen Platz..
Bedeutung der chemischen Bindung
Welche Bedeutung hat die chemische Bindung? Die unkalkulierbare Anzahl von Konsequenzen, die das Fehlen der chemischen Bindung auslösen würde, unterstreicht seine enorme Bedeutung in der Natur:
-Ohne sie würden keine Farben existieren, da ihre Elektronen keine elektromagnetische Strahlung absorbieren würden. Die in der Atmosphäre vorhandenen Staub- und Eispartikel würden verschwinden, und daher würde die blaue Farbe des Himmels dunkel werden..
-Kohlenstoff konnte seine endlosen Ketten nicht bilden, aus denen Billionen organischer und biologischer Verbindungen stammen.
-Proteine konnten nicht einmal in ihren Aminosäurebestandteilen definiert werden. Zucker und Fette sowie Kohlenstoffverbindungen in lebenden Organismen würden verschwinden.
-Die Erde würde ohne Atmosphäre bleiben, denn ohne chemische Bindungen in ihren Gasen würde es keine Kraft geben, sie zusammenzuhalten. Es würde auch nicht die geringste intermolekulare Wechselwirkung zwischen ihnen geben.
-Die Berge könnten verschwinden, weil ihre Gesteine und Mineralien, obwohl schwer, ihre Atome nicht in ihren kristallinen oder amorphen Strukturen enthalten könnten..
-Die Welt würde aus einzelnen Atomen bestehen, die keine festen oder flüssigen Substanzen bilden können. Dies würde auch zum Verschwinden jeglicher Transformation der Materie führen; das heißt, es würde keine chemische Reaktion geben. Nur flüchtige Gase überall.
Verweise
- Harry B. Gray. (1965). Elektronen und chemische Bindung. W.A. BENJAMIN, INC. P 36-39.
- Whitten, Davis, Peck & Stanley. Chemie. (8. Aufl.). CENGAGE Learning, S. 233, 251, 278, 279.
- Nave R. (2016). Chemische Verbindung. Wiederhergestellt von: hyperphysics.phy-astr.gsu.edu
- Chemische Bindungstypen. (3. Oktober 2006). Entnommen aus: dwb4.unl.edu
- Bildung chemischer Bindungen: Die Rolle von Elektronen. [PDF]. Wiederhergestellt von: cod.edu
- CK-12-Stiftung. (s.f.). Energie- und kovalente Bindungsbildung. Wiederhergestellt von: chem.libretexts.org
- Quimitube. (2012). Koordinate oder Dativ kovalente Bindung. Wiederhergestellt von: quimitube.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.