
Kondensierte Formel, was es ist und Beispiele (Methan, Ethan, Glucose ...)
Das kondensierte Formel Es ist eine rein textuelle Darstellung eines Moleküls, bei dem die Verknüpfungen weggelassen werden. Sein Zweck ist es, zu wissen, wie die Atome geordnet sind. Im Allgemeinen haben lineare oder verzweigte Moleküle kondensierte Formeln, mit Ausnahme von zyklischen oder stark verzweigten..
In der organischen Chemie gibt es oft Verwirrung darüber, was der Unterschied zwischen dieser und der molekularen Formel ist. In der Tat ist es üblich, sie als Synonyme zu finden. In der anorganischen Chemie werden inzwischen häufiger Molekülformeln verwendet, da sie in den meisten Fällen kovalente Verbindungen genau beschreiben; wie Wasser, H.zweiODER.
Artikelverzeichnis
- 1 Wie lautet die kondensierte Formel??
- 2 Beispiele
- 2.1 Methan
- 2.2 Ethan
- 2.3 Glukose und Fruktose
- 2.4 Butan
- 2,5 Ethanol
- 2.6 Pentan
- 2,7 Oktan
- 2.8 Cyclohexan
- 2.9 Aceton
- 2.10 Essigsäure
- 3 Allgemeiner Kommentar
- 4 Referenzen
Was ist die kondensierte Formel?
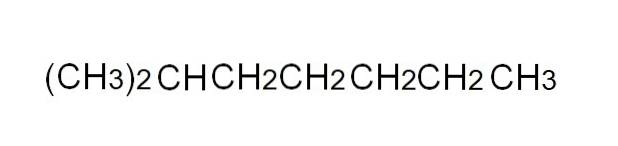
Um es bequemer zu definieren, ist die komprimierte Formel eine vereinfachte Darstellung der halb expandierten. Es ist nicht erforderlich, einzelne Links zu schreiben, und es muss auch nicht mehr als eine Zeile in einem Text umfassen. Beispielsweise kann 2-Methylheptan, ein verzweigtes Alkan, in derselben Linie wie im obigen Bild dargestellt werden.
Kondensierte Formeln sind nützlich, um einige Moleküle darzustellen, ohne sie zeichnen zu müssen. Dies ist hervorragend geeignet, wenn chemische Gleichungen geschrieben werden, an denen keine hochverzweigten oder cyclischen Moleküle beteiligt sind. Es ist ersichtlich, dass diese Formeln Klammern verwenden, um die Darstellung eines Moleküls weiter zu vereinfachen.
Beispiele
Methan
Methan ist die einzige chemische Verbindung, die eine einzige Formel hat: CH4. Dies entspricht der empirischen, molekularen, kondensierten und halbentwickelten gleichzeitig. Um Verwechslungen zwischen all diesen Konzepten zu vermeiden, ziehen es die Menschen daher oft vor, einfach und ungenau auf die „chemische Formel“ einer Verbindung zu verweisen.
Ethan
Ethan hat die Summenformel C.zweiH.6. Die kondensierte Formel lautet stattdessen CH3CH3. Beachten Sie, dass die C-C-Bindung und die C-H-Bindungen weggelassen werden. Die Idee ist, die Formel so schreiben zu können, als wäre sie ein „Wort“, ohne Linien oder Strukturen zeichnen zu müssen.
Per Definition lautet die Summenformel C.zweiH.6 und nicht CH3CH3;; Für einfache Moleküle werden jedoch beide Formeln zum Austausch verwendet, obwohl dies immer noch falsch ist. Dies ist ein Punkt der Diskrepanz zwischen verschiedenen Quellen, wo es anscheinend keine spezifischen Regeln in dieser Hinsicht gibt..
Glukose und Fruktose
Hier ist ein Beispiel, bei dem ein Fehler sofort beobachtet wird, wenn die Summenformel gegen die kondensierte ausgetauscht werden soll.
Das süße Paar, Glucose und Fructose, haben die gleiche Summenformel: C.6H.12ODER6, und deshalb dient dies nicht dazu, sie zu unterscheiden. Im Gegensatz dazu stellen die strukturellen und halbentwickelten Formeln visuell fest, dass es sich um verschiedene Moleküle handelt.
Weder Glucose noch Fructose haben jedoch eine kondensierte Formel. Dies liegt daran, dass ihre Strukturen unabhängig von ihrer Darstellung oder Projektion nicht in derselben Zeile geschrieben werden können. oder zumindest auf eine Weise, die in den Augen des Lesers angenehm und einfach ist.
Butan
Butan hat die Summenformel C.4H.10. Es hat zwei Isomere: das lineare, n-Butan und das verzweigte 2-Methylpropan. Beide können durch ihre komprimierten Formeln dargestellt werden. Das n-Butan ist CH3CHzweiCHzweiCH3 oder CH3(CHzwei)zweiCH3, und 2-Methylpropan ist CH3CH (CH3)zwei oder (CH3)3CH.
In 2-Methylpropan haben wir eine CH-Gruppe, die von drei CH umgeben ist3. Die beiden Formeln sind gültig, und Klammern werden verwendet, um die Zweige hervorzuheben. Der Index ist ein Indikator dafür, wie viele Gruppen diesen Zweig bilden.
Ethanol
Ethanol hat die kondensierte Formel CH3CHzweiOH. Beachten Sie, wie stark es seiner halbentwickelten Formel ähnelt: CH3-CHzwei-OH. Das gleiche geschieht mit Propanol, CH3CHzweiCHzweiOh das n-Butanol, CH3CHzweiCHzweiCHzweiOH und mit allen anderen Alkoholen.
Wenn sie einen Zweig haben, wird dieser in einer Klammer rechts neben dem Atom angezeigt, mit dem er verknüpft ist. Zum Beispiel könnte 2-Methylbutanol geschrieben werden als: CH3CHzweiCH (CH3) CHzweiOH. Es ist zu beachten, dass es für viele Moleküle bequemer wird, auf eine strukturelle oder halbentwickelte Formel zurückzugreifen.
Pentane
Das lineare Isomer von Pentan, n-Pentan ist es leicht durch seine kondensierte Formel darzustellen: CH3CHzweiCHzweiCHzweiCH3. Diese Formel kann auch mit Klammern vereinfacht werden: CH3(CHzwei)3CH3, zeigt an, dass zwischen den beiden CH3 Es gibt drei CHzwei.
Die beiden anderen Isomere von Pentan sind jedoch etwas komplizierter: CH3CHzweiCH (CH3)zwei, für 2-Methylbutan und C (CH3)4 für 2,2-Dimethylpropan oder Neopentan. Beachten Sie, dass das Kohlenstoffatom links von den Klammern dasjenige ist, das Bindungen mit den Substituenten oder Verzweigungen bildet..
Oktan
Das lineare Isomer von Oktan, n-Aufgrund seiner Länge ist es nun angebracht, seine kondensierte Formel als CH darzustellen3(CHzwei)6CH3. An diesem Punkt sollte etwas über kondensierte Formeln klar sein: Sie versuchen, Zeit bei der Darstellung von Molekülen oder Verbindungen zu sparen, ohne so viel auf Papier schreiben zu müssen.
Cyclohexan
Der Fall von Cyclohexan ähnelt dem von Glucose und Fructose: Es fehlt formal eine kondensierte Formel, da es sich um eine cyclische Verbindung handelt. Eine Möglichkeit, dies darzustellen, wäre: (CHzwei)6, was darauf hindeutet, dass sechs CH-Gruppenzwei müssen verknüpft werden, was nur möglich ist, wenn sie in einem sechseckigen Ring geschlossen sind. Es ist jedoch besser, den Ring zu zeichnen.
Aceton
Aceton hat die Besonderheit, eine Carbonylgruppe zu haben, C = O. Um seine komprimierte Formel zu schreiben, haben wir drei Möglichkeiten: (CH3)zweiCO, CH3C (O) CH3 oder CH3(C = O) CH3.
Tatsächlich wird in größeren Molekülen die Carbonylgruppe normalerweise als (O) dargestellt, wobei berücksichtigt wird, dass das Kohlenstoffatom zu seiner Linken dasjenige ist, das die Doppelbindung mit Sauerstoff bildet, C = O..
Essigsäure
Die kondensierte Essigsäureformel lautet CH3COOH oder CH3COzweiH. Hier ergibt sich ein wichtiger Punkt: Funktionsgruppen, die in derselben Zeile geschrieben sind, sind Teile einer kondensierten Formel. Dies war bei Ethanol und Aceton der Fall und gilt auch für Thiole (-SH), Aldehyde (-CHO), Ester (-CO)zweiR oder -COOR) und Amine (-NHzwei).
Allgemeiner Kommentar
Es gibt viel Verwirrung zwischen molekularen und kondensierten Formeln. Vielleicht liegt es daran, dass diese Darstellungen allein bereits ein grobes Bild des Moleküls liefern, weshalb wir glauben, dass es sich um die Molekülformel handelt.
Ebenso Formeln wie C.6H.12ODER6 Sie gelten auch als kondensiert, da das Molekül in ihnen vereinfacht zu Atomen und Indizes "kondensiert" wird. Deshalb ist es üblich zu sehen, wie die beiden Formeln erwähnt werden, als wären sie Synonyme.
In vielen Quellen, einschließlich Wikipedia-Artikeln, beziehen sich die Begriffe "chemische Formel" auf das Molekül (Typ C.6H.12ODER6 und andere) und "Formel", um sich auf die kondensierte zu beziehen.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Helmenstine, Anne Marie, Ph.D. (18. November 2019). Definition der kondensierten Formel in der Chemie. Wiederhergestellt von :oughtco.com
- James Ashenhurst. (11. Dezember 2019). Verkürzte Formeln: Entschlüsseln, was die Klammern bedeuten. Master Organische Chemie. Wiederhergestellt von: masterorganicchemistry.com
- Co-Engineering. (02. Mai 2016). Empirische, strukturelle und kondensierte Formel. Wiederhergestellt von: quimiotecablog.wordpress.com
- Einführung in die Chemie: Allgemein, Organisch und Biologisch. (s.f.). Kondensierte Struktur- und Linienwinkelformeln. Wiederhergestellt von: 2012books.lardbucket.org



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.