
Siliziumgeschichte, Eigenschaften, Struktur, Gewinnung, Verwendung
Das Silizium Es ist ein nichtmetallisches und gleichzeitig metalloides Element, das durch das chemische Symbol Si dargestellt wird. Es ist ein Halbleiter, der ein wesentlicher Bestandteil von Computern, Taschenrechnern, Mobiltelefonen, Solarzellen, Dioden usw.; Es ist praktisch die Hauptkomponente, die die Etablierung des digitalen Zeitalters ermöglicht hat.
Silizium war schon immer in Quarz und Silikaten enthalten, wobei beide Mineralien etwa 28 Massen-% der gesamten Erdkruste ausmachen. Es ist somit das zweithäufigste Element auf der Erdoberfläche, und die Weite der Wüsten und Strände bietet eine Perspektive, wie häufig es ist..

Silizium gehört zur Gruppe 14 des Periodensystems, genau wie Kohlenstoff, der sich darunter befindet. Deshalb wird dieses Element als vierwertiges Metalloid angesehen; Es hat vier Valenzelektronen und kann theoretisch alle verlieren, um das Kation Si zu bilden4+.
Eine Eigenschaft, die es mit Kohle teilt, ist seine Fähigkeit, sich miteinander zu verbinden. Das heißt, ihre Atome sind kovalent verknüpft, um Molekülketten zu definieren. Ebenso kann Silizium seine eigenen „Kohlenwasserstoffe“ bilden, die als Silane bezeichnet werden..
Die in der Natur vorherrschenden Siliziumverbindungen sind die berühmten Silikate. In seiner reinen Form kann es als monokristalliner, polykristalliner oder amorpher Feststoff erscheinen. Es ist ein relativ inerter Feststoff und stellt daher keine wesentlichen Risiken dar.
Artikelverzeichnis
- 1 Geschichte
- 1.1 Der Silikonstein
- 1.2 Isolierung
- 1.3 Kristallines Silizium
- 2 Physikalische und chemische Eigenschaften
- 2.1 Aussehen
- 2,2 Molmasse
- 2.3 Ordnungszahl (Z)
- 2.4 Schmelzpunkt
- 2,5 Siedepunkt
- 2.6 Dichte
- 2.7 Schmelzwärme
- 2.8 Verdampfungswärme
- 2,9 Molare Wärmekapazität
- 2.10 Elektronegativität
- 2.11 Ionisierungsenergien
- 2.12 Atomradius
- 2.13 Wärmeleitfähigkeit
- 2.14 Elektrischer Widerstand
- 2,15 Mohs Härte
- 2.16 Verkettung
- 2.17 Oxidationszahlen
- 2.18 Reaktivität
- 3 Aufbau und elektronische Konfiguration
- 3.1 Kovalenter Charakter
- 3.2 Elektrische Leitfähigkeit
- 3.3 Amorphes Silizium
- 4 Wo zu finden und zu erhalten
- 4.1 -Reduktion von Kieselsäure
- 5 Isotope
- 6 Risiken
- 7 Verwendungen
- 7.1 Bauindustrie
- 7.2 Glas und Keramik
- 7.3 Legierungen
- 7.4 Trockenmittel
- 7.5 Elektronikindustrie
- 7.6 Silikonpolymere
- 8 Referenzen
Geschichte
Silikonstein
Silizium ist vielleicht eines der Elemente, die den größten Einfluss in der Geschichte der Menschheit hatten.
Dieses Element ist der Protagonist der Steinzeit und auch des digitalen Zeitalters. Seine Ursprünge reichen zurück, als Zivilisationen einst mit Quarz arbeiteten und ihre eigenen Gläser herstellten; Derzeit ist es die Hauptkomponente von Computern, Laptops und Smartphones.
Silizium war praktisch der Stein zweier klar definierter Epochen in unserer Geschichte.
Isolation
Da Kieselsäure so reichlich vorhanden ist, ein Name, der aus Feuerstein stammt, muss sie ein äußerst reiches Element in der Erdkruste enthalten haben. Dies war der richtige Verdacht von Antoine Lavoisier, der 1787 bei seinen Versuchen, ihn von seinem Rost zu befreien, scheiterte.
Einige Zeit später, im Jahr 1808, machte Humphry Davy seine eigenen Versuche und gab dem Element seinen Vornamen: "Silicium", was übersetzt "Feuersteinmetall" werden würde. Das heißt, Silizium wurde dann aufgrund seiner mangelnden Charakterisierung als Metall angesehen..
1811 gelang es den französischen Chemikern Joseph L. Gay-Lussac und Louis Jacques Thénard erstmals, amorphes Silizium herzustellen. Dazu reagierten sie das Siliciumtetrafluorid mit metallischem Kalium. Sie reinigten oder charakterisierten das erhaltene Produkt jedoch nicht und kamen daher nicht zu dem Schluss, dass es sich um das neue Element Silicium handelt.
Erst 1823 erhielt der schwedische Chemiker Jacob Berzelius ein amorphes Silizium von ausreichender Reinheit, um es als Silizium zu erkennen. Name, der 1817 vom schottischen Chemiker Thomas Thomson gegeben wurde, als er es als nichtmetallisches Element betrachtete. Berzelius führte die Reaktion zwischen Kaliumfluorsilikat und geschmolzenem Kalium durch, um dieses Silizium herzustellen.
Kristallines Silizium
Kristallines Silizium wurde erstmals 1854 vom französischen Chemiker Henry Deville hergestellt. Um dies zu erreichen, führte Deville eine Elektrolyse eines Gemisches aus Aluminium- und Natriumchloriden durch und erhielt so Siliziumkristalle, die mit einer Schicht aus Aluminiumsilizid bedeckt waren, die er (anscheinend) durch Waschen mit Wasser eliminierte..
Physikalische und chemische Eigenschaften
Aussehen

Silizium in seiner reinen oder elementaren Form besteht aus einem grau oder bläulich-schwarzen Feststoff (oberes Bild), der zwar kein Metall ist, aber glänzende Gesichter hat, als ob es wirklich wäre.
Es ist ein harter, aber spröder Feststoff, der auch eine schuppige Oberfläche aufweist, wenn er aus Polykristallen besteht. Amorphes Silizium hingegen sieht aus wie ein dunkelbrauner pulverförmiger Feststoff. Dank dessen ist es einfach, eine Art von Silizium (kristallin oder polykristallin) von einer anderen (amorph) zu identifizieren und zu unterscheiden..
Molmasse
28,085 g / mol
Ordnungszahl (Z)
14 (14Ja)
Schmelzpunkt
1414 ºC
Siedepunkt
3265 ºC
Dichte
-Bei Raumtemperatur: 2,33 g / ml
-Direkt am Schmelzpunkt: 2,57 g / ml
Beachten Sie, dass flüssiges Silizium dichter als festes Silizium ist. was bedeutet, dass seine Kristalle auf einer flüssigen Phase derselben schwimmen, wie es beim Eiswassersystem der Fall ist. Die Erklärung beruht auf der Tatsache, dass der interatomare Raum zwischen den Si-Atomen in ihrem Kristall größer (weniger dicht) ist als der entsprechende in der Flüssigkeit (dichter)..
Schmelzwärme
50,21 kJ / mol
Verdampfungswärme
383 kJ / mol
Molare Wärmekapazität
19,789 J / (mol K)
Elektronegativität
1,90 auf der Pauling-Skala
Ionisierungsenergien
-Erstens: 786,5 kJ / mol
-Zweitens: 1577,1 kJ / mol
-Drittens: 3231,6 kJ / mol
Atomradio
111 pm (gemessen an ihren jeweiligen Diamantkristallen)
Wärmeleitfähigkeit
149 W / (m K)
Elektrischer widerstand
2.3 103 Ω · m bei 20 ºC
Mohs Härte
6.5
Verkettung
Siliziumatome haben die Fähigkeit, einfache Si-Si-Bindungen zu bilden, die am Ende eine Kette definieren (Si-Si-Si…)..
Diese Eigenschaft manifestiert sich auch in Kohlenstoff und Schwefel; jedoch sp-Hybridisierungen3 Silizium ist im Vergleich zu den beiden anderen Elementen mangelhafter und außerdem sind ihre 3p-Orbitale diffuser, so dass sich die sp-Orbitale überlappen3 Ergebnis ist schwächer.
Die durchschnittlichen Energien der kovalenten Si-Si- und C-C-Bindungen betragen 226 kJ / mol bzw. 356 kJ / mol. Daher sind die Si-Si-Bindungen schwächer. Aus diesem Grund ist Silizium nicht der Eckpfeiler des Lebens (und Schwefel auch nicht). Tatsächlich ist die längste Kette oder das längste Gerüst, die Silizium bilden kann, normalerweise viergliedrig (Si4).
Oxidationszahlen
Silizium kann eine der folgenden Oxidationszahlen haben, wobei in jedem von ihnen die Existenz von Ionen mit ihren jeweiligen Ladungen angenommen wird: -4 (Si4-), -3 (Ja3-), -2 (Jazwei-), -1 (Ja-), +1 (Ja+), +2 (Jazwei+), +3 (Ja3+) und +4 (Ja4+). Von allen sind -4 und +4 die wichtigsten.
Beispielsweise wird in Siliziden (Mg) -4 angenommenzweiJa oder Mgzweizwei+Ja4-); während +4 dem von Siliciumdioxid (SiO) entsprichtzwei oder wenn4+ODERzweizwei-).
Reaktivität
Silizium ist in Wasser sowie in starken Säuren oder Basen vollständig unlöslich. Es löst sich jedoch in einem konzentrierten Gemisch aus Salpetersäure und Flusssäure (HNO)3-HF). Ebenso löst es sich in einer heißen alkalischen Lösung, wobei die folgende chemische Reaktion auftritt:
Si (s) + 2NaOH (aq) + H.zweiO (l) => NazweiJa3(aq) + 2Hzwei(G)
Das Natriummetasilikatsalz NazweiJa3, Es entsteht auch, wenn sich Silizium in geschmolzenem Natriumcarbonat löst:
Si (s) + NazweiCO3(l) => NazweiJa3(l) + C (s)
Bei Raumtemperatur reagiert es überhaupt nicht mit Sauerstoff, auch nicht bei 900 ºC, wenn sich eine schützende Glasschicht aus SiO zu bilden beginntzwei;; und dann reagiert das Silizium bei 1400ºC mit dem Stickstoff in der Luft, um ein Gemisch aus Nitriden, SiN und Si zu bilden3N.4.
Silizium reagiert auch bei hohen Temperaturen mit Metallen unter Bildung von Metallsiliziden:
2 mg (s) + Si (s) => MgzweiJa (s)
2Cu (s) + Si (s) => CuzweiJa (s)
Bei Raumtemperatur reagiert es explosionsartig und direkt mit Halogenen (es gibt keine SiO-Schichtzwei um dich davor zu schützen). Zum Beispiel haben wir die Reaktion der Bildung von SiF4::
Ja (s) + 2Fzwei(g) => SiF4(G)
Und obwohl Silizium in Wasser unlöslich ist, reagiert es glühend heiß mit einem Dampfstrom:
Ja (s) + H.zweiO (g) => SiOzwei(s) + 2Hzwei(G)
Struktur und elektronische Konfiguration
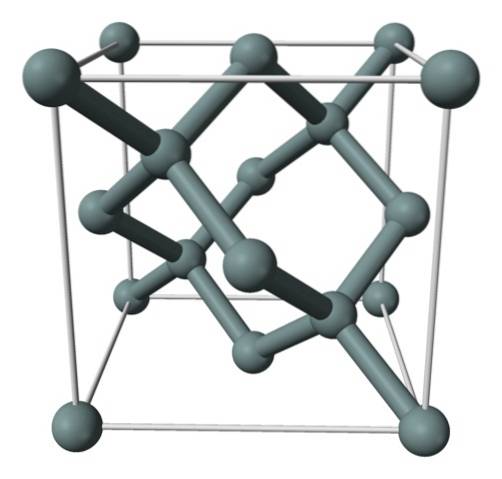
Das obige Bild zeigt die flächenzentrierte kubische Struktur (fcc), die der von Diamant für Siliziumkristalle entspricht. Die grauen Kugeln entsprechen den Si-Atomen, die, wie zu sehen ist, kovalent miteinander verbunden sind; Darüber hinaus haben sie tetraedrische Umgebungen, die entlang des Kristalls reproduziert werden.
Der Siliziumkristall ist fcc, weil auf jeder der Würfelflächen ein Si-Atom beobachtet wird (6 × 1/2). Ebenso befinden sich acht Si-Atome an den Eckpunkten des Würfels (8 × 1/8) und vier darin (diejenigen, die ein genau definiertes Tetraeder um sich herum zeigen, 4 × 1)..
Das heißt, jede Einheitszelle hat insgesamt acht Siliziumatome (3 + 1 + 4, Zahlen, die im obigen Absatz angegeben sind); Eine Eigenschaft, die die hohe Härte und Steifigkeit erklärt, da reines Silizium ein kovalenter kristallartiger Diamant ist.
Kovalenter Charakter
Dieser kovalente Charakter beruht auf der Tatsache, dass Silizium wie Kohlenstoff gemäß seiner elektronischen Konfiguration vier Valenzelektronen aufweist:
[Ne] 3szwei 3pzwei
Für die Bindung sind die reinen 3s- und 2p-Orbitale unbrauchbar. Deshalb erzeugt das Atom vier hybride sp-Orbitale3, mit denen es vier kovalente Si-Si-Bindungen bilden und auf diese Weise das Valenzoktett für die beiden Siliciumatome vervollständigen kann.
Der Siliziumkristall wird dann als kovalentes dreidimensionales Netzwerk sichtbar gemacht, das aus miteinander verbundenen Tetraedern besteht..
Dieses Netzwerk ist jedoch nicht perfekt, da es Defekte und Korngrenzen aufweist, die einen Kristall von einem anderen trennen und definieren. und wenn solche Kristalle sehr klein und zahlreich sind, sprechen wir von einem polykristallinen Feststoff, der durch seinen heterogenen Glanz identifiziert wird (ähnlich einem Silbermosaik oder einer schuppigen Oberfläche)..
Elektrische Leitfähigkeit
Die Si-Si-Bindungen mit ihren gut lokalisierten Elektronen stimmen im Prinzip nicht mit dem überein, was von einem Metall erwartet wird: einem Meer von Elektronen, die seine Atome "benetzen"; Zumindest ist dies bei Raumtemperatur so.
Wenn die Temperatur jedoch ansteigt, beginnt das Silizium Elektrizität zu leiten und verhält sich daher wie ein Metall; das heißt, es ist ein Halbleitermetalloidelement.
Amorphes Silizium
Siliziumtetraeder nehmen nicht immer ein Strukturmuster an, sondern können ungeordnet angeordnet sein; und sogar mit Siliciumatomen, deren Hybridisierungen nicht sp zu sein scheinen3 aber spzwei, Dies trägt dazu bei, den Grad der Störung weiter zu erhöhen. Wir sprechen daher von einem amorphen und nichtkristallinen Silizium.
In amorphem Silizium gibt es elektronische Leerstellen, in denen einige seiner Atome ein Orbital mit einem ungepaarten Elektron haben. Dank dessen kann sein Feststoff hydriert werden, wodurch sich hydriertes amorphes Silizium bildet. das heißt, es hat Si-H-Bindungen, mit denen die Tetraeder in ungeordneten und willkürlichen Positionen vervollständigt werden.
Dieser Abschnitt schließt mit der Aussage, dass Silizium in drei Arten von Feststoffen (ohne Angabe seines Reinheitsgrades) präsentiert werden kann: kristallin, polykristallin und amorph..
Jeder von ihnen hat seine eigene Produktionsmethode oder sein eigenes Verfahren sowie seine Anwendungen und Kompromisse bei der Entscheidung, welche der drei Methoden verwendet werden sollen, und kennt seine Vor- und Nachteile..
Wo zu finden und zu erhalten

Silizium ist das siebthäufigste Element im Universum und das zweite in der Erdkruste. Es bereichert auch den Erdmantel mit seiner riesigen Familie von Mineralien. Dieses Element verbindet sich sehr gut mit Sauerstoff und bildet eine breite Palette von Oxiden; unter ihnen Silica, SOzwei, und Silikate (unterschiedlicher chemischer Zusammensetzung).
Kieselsäure kann in Wüsten und Stränden mit bloßem Auge gesehen werden, da Sand hauptsächlich aus SiO bestehtzwei. Dieses Oxid kann wiederum in einigen wenigen Polymorphen vorkommen, wobei Quarz, Amethyst, Achat, Cristobalit, Tripolis, Coesit, Stishovit und Tridymit am häufigsten vorkommen. Darüber hinaus kann es in amorphen Feststoffen wie Opalen und Kieselgur gefunden werden..
Silikate sind strukturell und chemisch noch reicher. Einige der Silikatmineralien umfassen: Asbest (weiß, braun und bläulich), Feldspat, Tone, Glimmer, Olivine, Aluminosilikate, Zeolithe, Amphibole und Pyroxene.
Praktisch alle Gesteine bestehen aus Silizium und Sauerstoff mit ihren stabilen Si-O-Bindungen und ihren Kieselsäuren und Silikaten, die mit Metalloxiden und anorganischen Spezies gemischt sind..
-Kieselsäurereduktion
Das Problem bei der Gewinnung von Silizium besteht darin, die Si-O-Bindung aufzubrechen, für die spezielle Öfen und eine gute Reduktionsstrategie erforderlich sind. Der Rohstoff für diesen Prozess ist Kieselsäure in Form von Quarz, der zuvor gemahlen wird, bis er ein feines Pulver ist..
Aus dieser gemahlenen Kieselsäure kann entweder amorphes oder polykristallines Silizium hergestellt werden..
Amorphes Silizium
In kleinem Maßstab, in einem Labor und mit geeigneten Maßnahmen durchgeführt, wird Kieselsäure in einem Tiegel mit Magnesiumpulver gemischt und in Abwesenheit von Luft verbrannt. Die folgende Reaktion findet dann statt:
Jazwei(s) + Mg (s) => 2 mgO (s) + Si (s)
Magnesium und sein Oxid werden mit einer verdünnten Salzsäurelösung entfernt. Dann wird der verbleibende Feststoff mit Flusssäure behandelt, so dass das SiO vollständig reagiertzwei im Übermaß; Andernfalls begünstigt der Überschuss an Magnesium die Bildung seines jeweiligen Silizids MgzweiJa, unerwünschte Verbindung für den Prozess.
Das SiOzwei wird das flüchtige Gas SiF4, welches für andere chemische Synthesen gewonnen wird. Schließlich wird die amorphe Siliciummasse unter einem Wasserstoffgasstrom getrocknet..
Ein anderes ähnliches Verfahren zum Erhalten von amorphem Silizium besteht darin, dasselbe SiF zu verwenden4 zuvor hergestellt, oder das SiCl4 (zuvor gekauft). Die Dämpfe dieser Siliciumhalogenide werden in einer inerten Atmosphäre über flüssiges Natrium geleitet, so dass die Reduktion des Gases ohne Anwesenheit von Sauerstoff erfolgen kann:
SiCl4(g) + 4Na (l) => Si (s) + 4NaCl (l)
Interessanterweise werden aus amorphem Silizium hochenergetische Solarmodule hergestellt.
Kristallines Silizium
Ausgehend von der pulverisierten Kieselsäure oder dem Quarz werden sie zu einem Lichtbogenofen gebracht, wo sie mit Koks reagieren. Auf diese Weise ist das Reduktionsmittel kein Metall mehr, sondern ein kohlenstoffhaltiges Material von hoher Reinheit:
Jazwei(s) + 2C (s) => Si (s) + 2CO (g)
Die Reaktion erzeugt auch Siliciumcarbid, SiC, das mit einem Überschuss an SiO neutralisiert wirdzwei (wieder ist der Quarz im Überschuss):
2SiC (s) + SiOzwei(s) => 3Si (s) + 2CO (g)
Ein anderes Verfahren zur Herstellung von kristallinem Silizium ist die Verwendung von Aluminium als Reduktionsmittel:
3 JAzwei(s) + 4Al (l) => 3Si (s) + 2AlzweiODER3(s)
Und ausgehend vom Kaliumhexafluorurosilicatsalz K.zwei[SiF6] wird es auch mit metallischem Aluminium oder Kalium umgesetzt, um das gleiche Produkt herzustellen:
K.zwei[SiF6] (l) + 4Al (l) => 3Si (s) + 6KF (l) + 4AlF3(G)
Silizium löst sich sofort in geschmolzenem Aluminium auf, und wenn das System abgekühlt wird, kristallisiert das erste und trennt sich vom zweiten; das heißt, es werden Siliziumkristalle gebildet, die graue Farben erscheinen.
Polykristallines Silizium
Im Gegensatz zu den anderen Synthesen oder Produktionen beginnt man zur Gewinnung von polykristallinem Silizium mit einer Silangasphase, SiH4. Dieses Gas wird einer Pyrolyse über 500 ºC unterzogen, so dass eine thermische Zersetzung auftritt und somit aus seinen anfänglichen Dämpfen Polykristalle aus Silizium auf einer Halbleiteroberfläche abgeschieden werden.
Die folgende chemische Gleichung veranschaulicht die ablaufende Reaktion:
Ja H.4(g) => Si (s) + H.zwei(G)
Offensichtlich sollte sich kein Sauerstoff in der Kammer befinden, da dieser mit dem SiH reagieren würde4::
Ja H.4(g) + 20zwei(g) => SiOzwei(s) + 2HzweiO (g)
Und die Spontaneität der Verbrennungsreaktion ist so groß, dass sie bei Raumtemperatur schnell auftritt, wenn das Silan nur minimal Luft ausgesetzt wird..
Ein anderer Syntheseweg zur Herstellung dieser Art von Silizium beginnt mit kristallinem Silizium als Rohstoff. Sie lassen es mit Chlorwasserstoff bei einer Temperatur um 300 ºC reagieren, so dass Trichlorsilan entsteht:
Si (s) + 3HCl (g) => SiCl3H (g) + H.zwei(G)
Und das SiCl3H reagiert bei 1100 ºC, um das Silizium zu regenerieren, aber jetzt polykristallin:
4SiCl3H (g) => Si (s) + 3SiCl4(g) + 2Hzwei(G)
Schauen Sie sich einfach die Gleichungen an, um eine Vorstellung von der Arbeit und den strengen Produktionsparametern zu erhalten, die berücksichtigt werden müssen..
Isotope
Silizium kommt natürlich und hauptsächlich als Isotop vor 28Ja, mit einer Häufigkeit von 92,23%.
Darüber hinaus gibt es zwei weitere Isotope, die stabil sind und daher keinen radioaktiven Zerfall erfahren: 29Ja, mit einer Häufigkeit von 4,67%; Y. 30Ja, mit einer Häufigkeit von 3,10%. So reichlich vorhanden zu sein 28Ja, es ist nicht überraschend, dass das Atomgewicht von Silizium 28,084 u beträgt.
Silizium kann auch in mehreren Radioisotopen gefunden werden, darunter die 31Ja (t1/2= 2,62 Stunden) und 32Ja (t1/2= 153 Jahre). Andere (22Ja - 44Wenn sie haben t1/2 sehr kurz oder kurz (weniger als Hundertstelsekunden).
Risiken
Reines Silizium ist eine relativ inerte Substanz, daher reichert es sich normalerweise in keinem Organ oder Gewebe an, solange die Exposition gering ist. In Pulverform kann es die Augen reizen und Risse oder Rötungen verursachen, während das Berühren Hautbeschwerden, Juckreiz und Peeling verursachen kann..
Wenn die Exposition sehr hoch ist, kann Silizium die Lunge schädigen. aber ohne Nachwirkungen, es sei denn, die Menge reicht aus, um Erstickungsgefahr zu verursachen. Dies ist jedoch bei Quarz nicht der Fall, der mit Lungenkrebs und Krankheiten wie Bronchitis und Emphysem assoziiert ist..
Ebenso ist reines Silizium in der Natur sehr selten und seine Verbindungen, die in der Erdkruste so häufig vorkommen, stellen keine Gefahr für die Umwelt dar..
In Bezug auf Organosilicium könnten diese toxisch sein; Da es jedoch viele davon gibt, hängt es davon ab, welcher in Betracht gezogen wird, sowie von anderen Faktoren (Reaktivität, pH-Wert, Wirkmechanismus usw.)..
Anwendungen
Baugewerbe
Siliziummineralien bilden den "Stein", aus dem Gebäude, Häuser oder Denkmäler gebaut werden. Beispielsweise bestehen Zemente, Betone, Stucke und feuerfeste Steine aus festen Gemischen auf Silikatbasis. Aus diesem Ansatz kann man sich die Nützlichkeit dieses Elements in Städten und in der Architektur vorstellen..
Glas und Keramik
In optischen Geräten verwendete Kristalle können aus Siliciumdioxid hergestellt werden, sei es als Isolatoren, Probenzellen, Spektrophotometer, piezoelektrische Kristalle oder bloße Linsen..
Wenn das Material mit mehreren Additiven hergestellt wird, wandelt es sich ebenfalls in einen amorphen Feststoff um, der als Glas bekannt ist. und Sandberge sind normalerweise die Quelle der Kieselsäure oder des Quarzes, die für ihre Herstellung notwendig sind. Zum anderen werden mit Silikaten Keramikmaterialien und Porzellane hergestellt.
Silizium, das Ideen miteinander verbindet, ist auch im Handwerk und in der Verzierung vorhanden.
Legierungen
Siliziumatome können mit einer Metallmatrix verschmelzen und mit dieser mischbar sein, was sie zu einem Additiv für viele Legierungen oder Metalle macht. zum Beispiel Stahl, um Magnetkerne herzustellen; Bronzen zur Herstellung von Telefonkabeln; und Aluminium bei der Herstellung der Aluminium-Silizium-Legierung für leichte Automobilteile.
Daher kann es nicht nur im "Stein" von Gebäuden gefunden werden, sondern auch in den Metallen ihrer Säulen..
Trockenmittel

Kieselsäure in gelartiger oder amorpher Form ermöglicht die Herstellung von Feststoffen, die als Trockenmittel wirken, indem die in den Behälter eintretenden Wassermoleküle eingefangen und sein Inneres trocken gehalten werden..
Elektronikindustrie

Siliziumschichten unterschiedlicher Dicke und Farbe sind Teil von Computerchips, da mit ihren festen (kristallinen oder amorphen) integrierten Schaltkreisen und Solarzellen entworfen wurden.
Als Halbleiter enthält er Atome mit weniger (Al, B, Ga) oder mehr Elektronen (P, As, Sb), um ihn in Halbleiter dieses Typs umzuwandeln p oder n, beziehungsweise. Mit den Verbindungen zweier Silikone, eines n und der andere p, Leuchtdioden werden hergestellt.
Silikonpolymere
Der berühmte Silikonkleber besteht aus einem organischen Polymer, das durch die Stabilität der Ketten von Si-O-Si-Bindungen unterstützt wird. Wenn diese Ketten sehr lang, kurz oder vernetzt sind, ändern sich auch die Eigenschaften des Silikonpolymers ihre endgültigen Anwendungen..
Unter den nachstehend aufgeführten Verwendungen können die folgenden erwähnt werden:
-Klebstoffe oder Klebstoffe, nicht nur zum Verbinden von Papieren, sondern auch von Bausteinen, Gummis, Glasscheiben, Steinen usw..
-Schmiermittel in hydraulischen Bremssystemen
-Stärkt Farben und verbessert die Helligkeit und Intensität ihrer Farben, während sie Temperaturänderungen standhalten, ohne zu reißen oder zu fressen.
-Sie werden als wasserabweisende Sprays verwendet, die einige Oberflächen oder Gegenstände trocken halten
-Sie geben Körperpflegeprodukten (Zahnpasten, Shampoos, Gele, Rasiercremes usw.) das Gefühl, seidig zu sein
-Seine Beschichtungen schützen die elektronischen Komponenten empfindlicher Geräte wie Mikroprozessoren vor Hitze und Feuchtigkeit
-Mit Silikonpolymeren wurden mehrere Gummibälle hergestellt, die abprallen, sobald sie auf den Boden fallen..
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Silizium. Wiederhergestellt von: en.wikipedia.org
- MicroChemicals. (s.f.). Kristallographie von Silizium. Wiederhergestellt von: microchemicals.com
- Lenntech B.V. (2019). Periodensystem: Silizium. Wiederhergestellt von: lenntech.com
- Marques Miguel. (s.f.). Siliziumvorkommen. Wiederhergestellt von: nautilus.fis.uc.pt
- Mehr Hemant. (5. November 2017). Silizium. Wiederhergestellt von: hemantmore.org.in
- Pilgaard Michael. (22. August 2018). Silizium: Vorkommen, Isolierung und Synthese. Wiederhergestellt von: pilgaardelements.com
- Dr. Doug Stewart. (2019). Fakten zu Siliziumelementen. Chemicool. Wiederhergestellt von: chemicool.com
- Christiana Honsberg und Stuart Bowden. (2019). Eine Sammlung von Ressourcen für den Photovoltaik-Pädagogen. PVeducation. Wiederhergestellt von: pveducation.org
- American Chemistry Council, Inc. (2019). Silikone im Alltag. Wiederhergestellt von: sehsc.americanchemistry.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.