
Racemische Mischung der Chiralität, Beispiele

EIN racemische Mischung oder Racemat ist eines, das zu gleichen Teilen aus zwei Enantiomeren besteht und daher optisch inaktiv ist. Diese optische Aktivität bezieht sich auf die Fähigkeit seiner Lösungen, einen polarisierten Lichtstrahl, der sich durch sie in eine Richtung bewegt, im oder gegen den Uhrzeigersinn zu drehen..
Ein Enantiomer kann polarisiertes Licht beispielsweise nach links (linkshändig) drehen, sodass seine reine Lösung optisch aktiv ist. Wenn jedoch das Enantiomer, das das Licht nach rechts dreht (rechtsdrehend), hinzugefügt wird, nimmt seine optische Aktivität ab, bis es inaktiviert wird..

Wenn dies geschieht, wird gesagt, dass es gleiche Mengen der linken und rechten Enantiomere gibt; Wenn ein Molekül das polarisierte Licht nach links dreht, wird seine Wirkung sofort aufgehoben, wenn es mit einem anderen Molekül "stolpert", das es nach rechts dreht. Und so weiter. Daher werden wir eine racemische Mischung haben.
Die erste Sichtung der Enantiomerie erfolgte 1848 durch den französischen Chemiker Louis Pasteur, der eine Mischung aus enantiomeren Kristallen der Weinsäure (damals Raceminsäure genannt) untersuchte. Da diese Säure aus den Trauben stammte, aus denen Weine hergestellt wurden, wurde diese Mischung allgemein für alle Moleküle angewendet.
Artikelverzeichnis
- 1 Schuhe und Chiralität
- 2 Beispiele
- 2.1 Weinsäure
- 2.2 Chinin
- 2.3 Thalidomid
- 2,4 1,2-Epoxypropan
- 2,5 1-Phenylethylamin
- 2.6 Schlussbemerkung
- 3 Referenzen
Schuhe und Chiralität
Erstens, damit es eine racemische Mischung gibt, müssen (normalerweise) zwei Enantiomere vorhanden sein, was impliziert, dass beide Moleküle chiral sind und dass ihre Spiegelbilder nicht überlagert werden können. Ein Paar Schuhe veranschaulicht dies perfekt: Egal wie sehr Sie versuchen, den linken Schuh auf den rechten zu legen, sie werden niemals passen..
Der rechte Schuh lenkt das polarisierte Licht nach links ab; während der linke Schuh es nach rechts macht. In einer hypothetischen Lösung, in der die Schuhe die Moleküle sind, ist dies optisch aktiv, wenn es nur gerade, chirale Schuhe gibt. Das gleiche passiert, wenn nur noch Schuhe in Lösung sind.
Wenn jedoch tausend linke Schuhe mit tausend rechten Schuhen gemischt sind, haben wir eine racemische Mischung, die auch optisch inaktiv ist, da sich die Abweichungen, unter denen das Licht im Inneren leidet, gegenseitig aufheben..
Wenn sie anstelle von Schuhen Kugeln wären, Objekte, die achiral sind, wäre es unmöglich, dass racemische Gemische davon existieren, da sie nicht einmal als Enantiomerenpaare existieren könnten.
Beispiele
Weinsäure
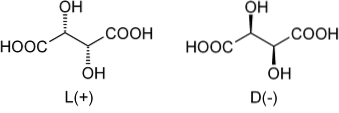
Zurück zu Weinsäure, war seine racemische Mischung die erste, die bekannt wurde. Im oberen Bild sind zwei Enantiomere dargestellt, von denen jedes Kristalle mit morphologischen "linken" oder "rechten" Flächen bilden kann. Mit Hilfe eines Mikroskops und strenger Bemühungen gelang es Pasteur, diese enantiomeren Kristalle voneinander zu trennen..
Die Kristalle der L (+) - und D (-) - Enantiomere zeigen getrennt optische Aktivität, indem sie polarisiertes Licht nach rechts bzw. links ablenken. Wenn sich beide Kristalle in gleichen Molanteilen in Wasser lösen, wird eine optisch inaktive racemische Mischung erhalten..
Beachten Sie, dass beide Enantiomere zwei chirale Kohlenstoffe (mit vier verschiedenen Substituenten) aufweisen. In L (+) liegen die OHs hinter der Ebene, die vom Kohlenstoffgerüst und den COOH-Gruppen gebildet wird; während in D (-) diese OHs über der Ebene liegen.
Diejenigen, die Weinsäure synthetisieren, erhalten eine racemische Mischung. Um das L (+) - Enantiomer vom D (-) zu trennen, ist eine chirale Auflösung erforderlich, bei der diese Mischung mit einer chiralen Base umgesetzt wird, um diastereoisomere Salze zu erzeugen, die später durch fraktionierte Kristallisation abgetrennt werden können..
Chinin

In dem obigen Beispiel wird, um sich auf ein racemisches Gemisch von Weinsäure zu beziehen, üblicherweise als (±) Weinsäure geschrieben. Im Fall von Chinin (oberes Bild) ist es also (±) -Kinin.
Die Isomerie von Chinin ist komplex: Es hat vier chirale Kohlenstoffe, aus denen 16 Diastereoisomere entstehen. Interessanterweise sind zwei seiner Enantiomere (eines mit dem OH über der Ebene und das andere unter der Ebene) tatsächlich Diastereoisomere, da sie sich in der Konfiguration ihrer anderen chiralen Kohlenstoffe (die des Bicyclos mit dem N-Atom) unterscheiden..
Es ist jedoch schwierig zu bestimmen, welches der Stereoisomere von Chinin polarisiertes Licht nach rechts oder links ablenkt..
Thalidomid
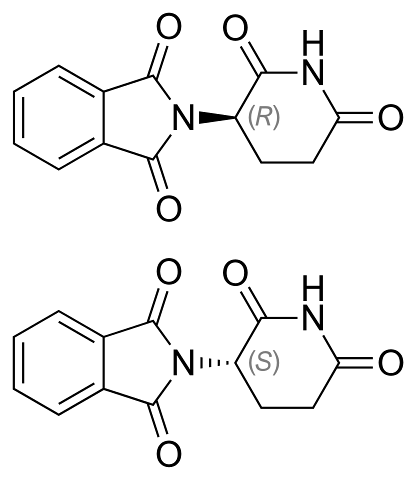
Die Enantiomere von Thalidomid sind oben gezeigt. Es hat nur einen chiralen Kohlenstoff: den, der an den Stickstoff gebunden ist, der beide Ringe verbindet (einer aus Phthalimid und der andere aus Gluteramid)..
Im R-Enantiomer (mit sedierenden Eigenschaften) ist der Phthalimidring (der linke) über der Ebene ausgerichtet; während im S-Enantiomer (mit mutagenen Eigenschaften) unten.
Dem Augenprozentsatz ist nicht bekannt, welcher der beiden das Licht nach links oder rechts ablenkt. Es ist bekannt, dass ein 1: 1 oder 50% iges Gemisch beider Enantiomere das racemische Gemisch (±) -Talidomid bildet.
Wenn Sie Thalidomid nur als hypnotisches Beruhigungsmittel vermarkten möchten, ist es zwingend erforderlich, seine racemische Mischung der bereits erwähnten chiralen Auflösung so zu unterziehen, dass das reine R-Enantiomer erhalten wird..
1,2-Epoxypropan
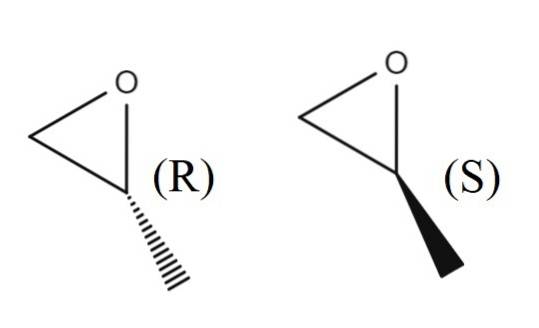
Im oberen Bild sehen Sie das Enantiomerenpaar 1,2-Epoxypropan. Das R-Enantiomer lenkt polarisiertes Licht nach rechts ab, während das S-Enantiomer es nach links ablenkt. das erste ist (R) - (+) - 1,2-Epoxypropan und das zweite ist (S) - (-) - 1,2-Epoxypropan.
Das racemische Gemisch der beiden wird wiederum in einem Verhältnis von 1: 1 oder 50% zu (±) -1,2-Epoxypropan.
1-Phenylethylamin
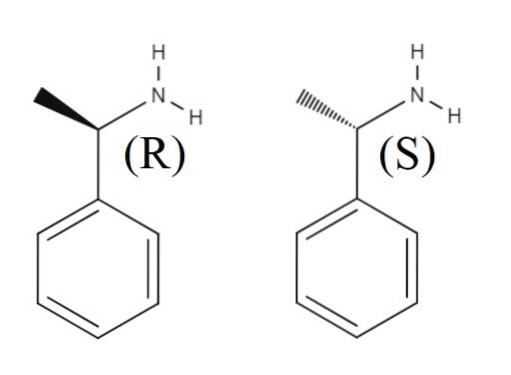
Oben ist eine weitere racemische Mischung dargestellt, die durch die beiden Enantiomere von 1-Phenylethylamin gebildet wird. Das R-Enantiomer ist (R) - (+) - 1-Phenylethylamin und das S-Enantiomer ist (S) - (-) - 1-Phenylethylamin; man hat die Methylgruppe CH3, zeigt aus der Ebene des aromatischen Rings und der andere zeigt darunter.
Es ist zu beachten, dass wenn die Konfiguration R ist, dies manchmal mit der Tatsache zusammenfällt, dass das Enantiomer das polarisierte Licht nach rechts dreht; Dies gilt jedoch nicht immer und kann nicht als allgemeine Regel angesehen werden.
Abschließender Kommentar
Wichtiger als das Vorhandensein oder Nichtvorhandensein von racemischen Gemischen ist ihre chirale Auflösung. Dies gilt insbesondere für Verbindungen mit pharmakologischen Wirkungen, die von dieser Stereoisomerie abhängen; Das heißt, ein Enantiomer kann für den Patienten von Vorteil sein, während das andere ihn beeinflussen kann.
Aus diesem Grund werden diese chiralen Auflösungen verwendet, um die racemischen Gemische in ihre Bestandteile zu trennen und sie somit als reine Arzneimittel ohne schädliche Verunreinigungen zu vermarkten..
Verweise
- Morrison, R. T. und Boyd, R., N. (1987). Organische Chemie. 5. Auflage. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10. Auflage). Wiley plus.
- Steven A. Hardinger. (2017). Illustriertes Glossar der Organischen Chemie: Racemische Mischung. Institut für Chemie & Biochemie, UCLA. Wiederhergestellt von: chem.ucla.edu
- Nancy Devino. (2019). Racemische Mischung: Definition & Beispiel. Studie. Wiederhergestellt von: study.com
- James Ashenhurst. (2019). Stereochemie und Chiralität: Was ist eine racemische Mischung? Wiederhergestellt von: masterorganicchemistry.com
- John C. Leffingwell. (2003). Chiralität & Bioaktivität I .: Pharmakologie. [PDF]. Wiederhergestellt von: leffingwell.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.