
Beispiele für aromatische nukleophile Substitutionseffekte
Das aromatische nukleophile Substitution (SNAr) ist eine Reaktion, die in der organischen Chemie auftritt und aus der Verdrängung einer guten Abgangsgruppe durch ein ankommendes Nucleophil besteht. Unter dem Gesichtspunkt seines Mechanismus und seiner elektronischen Aspekte ist es die Gegenseite der elektrophilen aromatischen Substitution (SEAr)..
Im Allgemeinen ist die Abgangsgruppe ein Halogen, das als Halogenidanion X austritt-. Diese Reaktion kann nur stattfinden, wenn dem aromatischen Ring (meistens Benzol) Elektronen fehlen; das heißt, wenn es elektronenziehende Substituentengruppen aufweist.

Das obere Bild zeigt, was im vorherigen Absatz gesagt wurde. Die Elektronenattraktorgruppe EWG (für ihr Akronym in Englisch: Electron Withdrawing Group) aktiviert den aromatischen Ring für den nukleophilen Angriff der negativen Spezies Nu-. Es ist ersichtlich, dass ein Zwischenprodukt (in der Mitte) gebildet wird, aus dem das Halogenid X freigesetzt wird oder austritt-.
Man beachte, dass in einfachen Worten Nu in einem aromatischen Ring durch X ersetzt wird. Diese Reaktion ist sehr vielseitig und notwendig für die Synthese neuer Wirkstoffe sowie für Studien zur synthetischen organischen Chemie..
Artikelverzeichnis
- 1 Allgemeine Aspekte
- 1.1 Unterschiede zur elektrophilen aromatischen Substitution
- 2 Effekte
- 2.1 Von der Anzahl der Substituenten
- 2.2 Aus der Abgangsgruppe
- 3 Beispiel
- 3.1 Schlussbemerkung
- 4 Referenzen
Allgemeine Merkmale
Der aromatische Ring kann abhängig von seinen Substituenten (die die ursprüngliche CH-Bindung ersetzen) von Elektronen "geladen" oder "entladen" werden..
Wenn diese Substituenten dem Ring Elektronendichte verleihen können, sollen sie ihn mit Elektronen anreichern; Wenn sie im Gegenteil Attraktoren der Elektronendichte sind (die oben erwähnte EWG), dann heißt es, dass sie den Elektronenring verarmen.
In beiden Fällen wird der Ring für eine bestimmte aromatische Reaktion aktiviert, während er für die andere deaktiviert wird..
Beispielsweise soll ein elektronenreicher aromatischer Ring für die elektrophile aromatische Substitution aktiv sein; das heißt, es kann seine Elektronen an eine elektrophile Spezies abgeben, E.+. Es werden jedoch keine Elektronen an eine Nu-Spezies abgegeben-, da negative Ladungen sich gegenseitig abstoßen würden.
Wenn der Ring arm an Elektronen ist, hat er keine Möglichkeit, sie der Spezies E zu geben+ (SEAr tritt nicht auf); Andererseits hat es die Verfügbarkeit, die Elektronen der Nu-Spezies aufzunehmen- (der SNAr wird entwickelt).
Unterschiede bei der aromatischen elektrophilen Substitution
Nachdem die allgemeinen Eingabeaspekte geklärt wurden, können nun einige Unterschiede zwischen dem SNAr und dem SEAr aufgelistet werden:
- Der aromatische Ring wirkt als Elektrophil (elektronenarm) und wird von einem Nucleophil angegriffen.
- Eine Abgangsgruppe X ist am Ring substituiert; kein H.+
- Es entstehen keine Carbokationen, sondern Intermediäre mit einer negativen Ladung, die durch Resonanz delokalisiert werden können
- Das Vorhandensein von mehr Attraktorgruppen im Ring beschleunigt die Substitution, anstatt sie zu verlangsamen
- Schließlich haben diese Gruppen keine direkten Auswirkungen darauf, wo (auf welchem Kohlenstoff) die Substitution stattfinden wird. Die Substitution erfolgt immer an dem Kohlenstoff, der an die Abgangsgruppe X gebunden ist.
Der letzte Punkt ist auch im Bild dargestellt: Die C-X-Bindung bricht, um die neue C-Nu-Bindung zu bilden.
Effekte bearbeiten
Von der Anzahl der Substituenten
Je elektronenarmer der Ring ist, desto schneller ist natürlich die rSNA und desto weniger drastisch sind die Bedingungen, unter denen sie auftreten kann. Betrachten Sie das folgende Beispiel in der Abbildung unten:
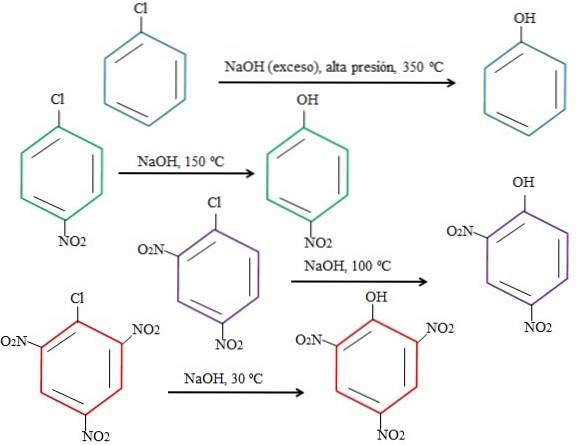
Es ist zu beachten, dass 4-Nitrochlorbenzol (blauer Ring) drastische Bedingungen (hoher Druck und eine Temperatur von 350 ºC) erfordert, damit Cl durch OH ersetzt werden kann. In diesem Fall ist Chlor die Abgangsgruppe (Cl-) und hydroxidiere das Nucleophil (OH-).
Wenn die Gruppe NO erscheintzwei, Dies ist ein Elektronenattraktor (grüner Ring). Die Substitution kann bei einer Temperatur von 150 ° C bei Umgebungsdruck durchgeführt werden. Wenn die Anzahl der NO-Gruppen zunimmtzwei vorhanden (violette und rote Ringe), erfolgt die Substitution bei niedrigeren und niedrigeren Temperaturen (100 ° C bzw. 30 ° C).
Daher sind die Gruppen NICHTzwei Beschleunigen Sie rSNA und berauben Sie den Elektronenring, wodurch er anfälliger für OH-Angriffe wird-.
Die relativen Positionen von Cl in Bezug auf NO werden hier nicht erklärt.zwei in 4-Nitrochlorbenzol und wie diese die Reaktionsgeschwindigkeit verändern; Beispielsweise sind die Reaktionsgeschwindigkeiten von 2-Nitrochlorbenzol und 3-Nitrochlorbenzol unterschiedlich, wobei letzteres im Vergleich zu den anderen Isomeren am langsamsten ist.
Aus der ausgehenden Gruppe
Bei der Rückgewinnung von 4-Nitrochlorbenzol ist seine Substitutionsreaktion im Vergleich zu seinem fluorierten Gegenstück langsamer:
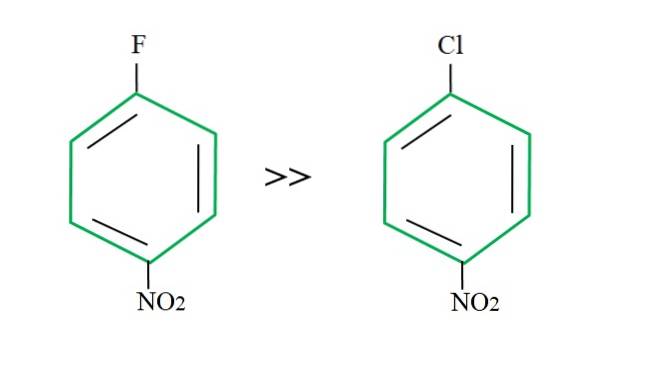
Die Erklärung dafür kann in keiner anderen Variablen als dem Unterschied zwischen F und Cl liegen. Fluor ist eine schreckliche Abgangsgruppe, da die C-F-Bindung schwieriger zu brechen ist als die C-Cl-Bindung. Daher ist das Aufbrechen dieser Bindung nicht der bestimmende Schritt der Geschwindigkeit für den SNAr, sondern die Zugabe des Nu- zum aromatischen Ring.
Da Fluor elektronegativer als Chlor ist, weist das damit verbundene Kohlenstoffatom einen größeren elektronischen Mangel auf (C.δ+-F.δ-). Folglich ist der Kohlenstoff der CF-Bindung viel anfälliger für Angriffe durch Nu- als die der C-Cl-Bindung. Deshalb ist die Substitution von OH durch F viel schneller als die von OH durch Cl.
Beispiel
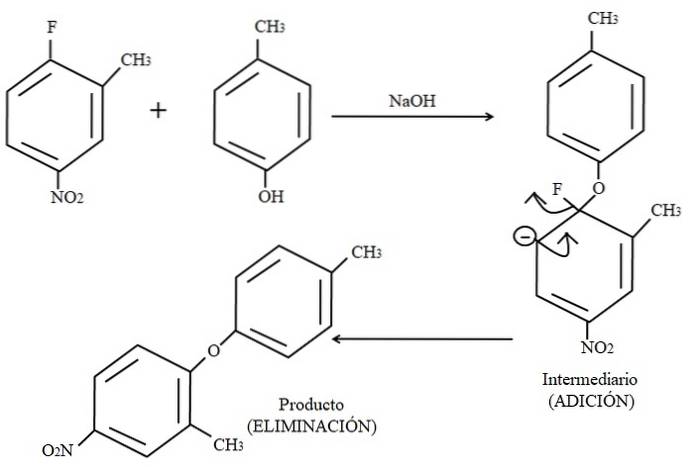
Ein Beispiel für diese Art von organischen Reaktionen ist im obigen Bild unten dargestellt. Para-Kresol scheint kein Nucleophil zu sein; Da es jedoch ein basisches Medium gibt, wird seine OH-Gruppe deprotoniert, so dass es als Phenoxidanion zurückbleibt, das 2-Methyl-4-nitrofluorbenzol angreift.
Wenn dieser Angriff auftritt, soll das Nucleophil zum Elektrophil (dem aromatischen Ring von 2-Methyl-4-nitrofluorbenzol) addieren. Dieser Schritt ist rechts im Bild zu sehen, wo die Zwischenverbindung mit beiden zum Ring gehörenden Substituenten gebildet wird.
Wenn Para-Kresol hinzugefügt wird, erscheint eine negative Ladung, die durch Resonanz innerhalb des Rings delokalisiert wird (beachten Sie, dass es nicht mehr aromatisch ist)..
Im Bild ist nur die letzte Resonanzstruktur dargestellt, von der das Fluor als F endet-;; In Wirklichkeit wird diese negative Ladung jedoch selbst in den Sauerstoffatomen der NO-Gruppe delokalisiertzwei. Nach dem Zugabeschritt folgt der Eliminierungsschritt, der letzte, bei dem das Produkt schließlich gebildet wird.
Abschließender Kommentar
Die Gruppe NRzwei Rest kann auf die NH-Gruppe reduziert werdenzwei, und von dort ist es möglich, mehr Synthesereaktionen durchzuführen, um das endgültige Molekül zu modifizieren. Dies unterstreicht das Synthesepotential von rSNA und dass sein Mechanismus auch aus zwei Schritten besteht: einem zur Addition und einem zur Eliminierung..
Derzeit gibt es jedoch experimentelle und rechnerische Beweise dafür, dass die Reaktion tatsächlich nach einem konzertierten Mechanismus abläuft, bei dem beide Schritte gleichzeitig über einen aktivierten Komplex und nicht über ein Zwischenprodukt ablaufen..
Verweise
- Morrison, R. T. und Boyd, R., N. (1987). Organische Chemie. 5. Auflage. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10. Auflage). Wiley plus.
- Wikipedia. (2019). Nucleophile aromatische Substitution. Wiederhergestellt von: en.wikipedia.org
- James Ashenhurst. (06. September 2019). Nucleophile aromatische Substitution (NAS). Wiederhergestellt von: masterorganicchemistry.com
- Chemie LibreTexts. (05. Juni 2019). Nucleophile aromatische Substitution. Wiederhergestellt von: chem.libretexts.org



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.