
Selen Geschichte, Eigenschaften, Struktur, Gewinnung, Verwendung
Das Selen Es ist ein nichtmetallisches chemisches Element, das zur Gruppe 16 des Periodensystems gehört und durch das Symbol Se dargestellt wird. Dieses Element hat Zwischeneigenschaften zwischen Schwefel und Tellur, die Mitglieder derselben Gruppe sind.
Selen wurde 1817 von Jöhs J. Berzelius und John G. Gahn entdeckt, die beim Verdampfen des Pyrits einen roten Rückstand beobachteten (unteres Bild). Zuerst verwechselten sie es mit Tellur, aber dann stellten sie fest, dass es sich um ein neues Element handelte.

Berzelius nannte das neue Element Selen, basierend auf dem Namen "Selene", was "Göttin des Mondes" bedeutet. Selen ist ein essentielles Spurenelement für Pflanzen und Tiere, obwohl es in hohen Konzentrationen ein toxisches Element ist.
Selen hat drei allotrope Hauptformen: Rot, Schwarz und Grau. Letzteres hat die Eigenschaft, seine elektrische Leitfähigkeit in Abhängigkeit von der Intensität des Lichts zu modifizieren, das es ausstrahlt (Fotoleiter), für das es viele Anwendungen hatte.
Selen ist in der Erdkruste weit verbreitet, die Mineralien, die es enthalten, sind jedoch nicht reichlich vorhanden, sodass kein Selenabbau stattfindet.
Es wird hauptsächlich als Nebenprodukt des Kupferelektrolyse-Raffinierungsprozesses erhalten. Selen reichert sich im Schlick an der Anode der Elektrolysezellen an.
Der Mensch besitzt rund 25 Selenoproteine, von denen einige eine antioxidative Wirkung haben und die Bildung freier Radikale kontrollieren. Es gibt auch Aminosäuren von Selen wie Selenomethionin und Selenocystein.
Artikelverzeichnis
- 1 Geschichte
- 1.1 Erste Beobachtung
- 1.2 Ermittlung
- 1.3 Herkunft seines Namens
- 1.4 Entwickeln Sie Ihre Anwendungen
- 2 Physikalische und chemische Eigenschaften
- 2.1 Aussehen
- 2.2 Standardatomgewicht
- 2.3 Ordnungszahl (Z)
- 2.4 Schmelzpunkt
- 2,5 Siedepunkt
- 2.6 Dichte
- 2.7 Schmelzwärme
- 2.8 Verdampfungswärme
- 2,9 Molare Wärmekapazität
- 2.10 Oxidationszahlen
- 2.11 Elektronegativität
- 2.12 Ionisierungsenergie
- 2.13 Magnetische Ordnung
- 2.14 Härte
- 2.15 Isotope
- 2.16 Allotropie
- 3 Reaktivität
- 3.1 Reaktion mit Wasserstoff
- 3.2 Reaktion mit Sauerstoff
- 3.3 Reaktion mit Halogenen
- 3.4 Reaktion mit Metallen
- 3.5 Selenite
- 3.6 Säuren
- 4 Aufbau und elektronische Konfiguration
- 4.1 - Selen und seine Bindungen
- 4.2 - Ringe oder Ketten
- 4.3 - Allotrope
- 5 Wo zu finden und zu produzieren
- 5.1 Elektrolyse von Kupfer
- 6 Biologische Rolle
- 6.1 Mangel
- 6.2 Enzym-Cofaktor
- 6.3 Proteine und Aminosäuren
- 7 Risiken
- 8 Verwendungen
- 8.1 Kosmetik
- 8.2 Ärzte
- 8.3 Elektrolyse von Mangan
- 8.4 Pigment
- 8.5 Fotoleiter
- 8.6 Kristalle
- 8.7 Vulkanisation
- 8.8 Legierungen
- 8.9 Gleichrichter
- 9 Referenzen
Geschichte
Erste Beobachtung
Der Alchemist Arnold de Villanova hat möglicherweise 1230 Selen beobachtet. Er studierte Medizin an der Sorbonne in Paris und war sogar Arzt von Papst Clemens V..
Villanova in seinem Buch Rosarium Philosophorum beschreibt einen roten Schwefel oder "Schwefelrebeum", der nach dem Verdampfen des Schwefels in einem Ofen zurückgelassen wurde. Dieser rote Schwefel könnte ein Allotrop von Selen gewesen sein.
Entdeckung
1817 entdeckten Jöhs Jakob Berzelius und John Gottlieb Gahn Selen in einer Chemiefabrik zur Herstellung von Schwefelsäure in der Nähe von Gripsholm, Schweden. Der Rohstoff für die Herstellung der Säure war Pyrit, der aus einer Falun-Mine gewonnen wurde..
Berzelius war beeindruckt von der Existenz eines roten Rückstands, der nach dem Verbrennen des Schwefels im Bleibehälter zurückblieb.
Auch Berzelius und Gahn beobachteten, dass der rote Rückstand einen starken Meerrettichgeruch hatte, ähnlich dem von Tellur. Deshalb schrieb er an seinen Freund Marect, dass sie glaubten, dass die beobachtete Ablagerung eine Tellurverbindung sei..
Berselius analysierte jedoch weiterhin das Material, das sich bei der Verbrennung des Pyrits abgelagert hatte, und überlegte, ob in der Falun-Mine kein Tellur gefunden worden war. Er kam im Februar 1818 zu dem Schluss, dass er ein neues Element entdeckt hatte.
Herkunft seines Namens
Berzelius wies darauf hin, dass das neue Element eine Kombination aus Schwefel und Tellur sei und dass die Ähnlichkeit von Tellur mit dem neuen Element ihm die Möglichkeit gegeben habe, die neue Substanz Selen zu benennen..
Berzelius erklärte, dass "Tellus" die Göttin der Erde bedeutet. Martin Klaport gab Tellurium 1799 diesen Namen und schrieb: „Kein einzelnes Element heißt so. Es musste getan werden! ".
Wegen der Ähnlichkeit von Tellur mit der neuen Substanz nannte Berzelius es das Wort Selen, abgeleitet vom griechischen Wort "Selene", was "Göttin des Mondes" bedeutet..
Entwicklung Ihrer Anwendungen
1873 entdeckte Willoughby Smith, dass die elektrische Leitfähigkeit von Selen von dem Licht abhängt, das es ausstrahlt. Diese Eigenschaft ermöglichte es Selen, zahlreiche Anwendungen zu haben.
Alexander Graham Bell verwendete 1979 Selen in seinem Fotophon. Selen erzeugt einen elektrischen Strom, der proportional zur Intensität des Lichts ist, das es beleuchtet, und wird in Belichtungsmessern, Sicherheitsmechanismen zum Öffnen und Schließen von Türen usw. verwendet..
Die Verwendung von Selengleichrichtern in der Elektronik begann in den 1930er Jahren mit zahlreichen kommerziellen Anwendungen. In den 1970er Jahren wurde es in Gleichrichtern durch Silizium ersetzt.
1957 wurde entdeckt, dass Selen ein wesentliches Element für das Leben von Säugetieren ist, da es in Enzymen enthalten ist, die vor reaktivem Sauerstoff und freien Radikalen schützen. Darüber hinaus wurde die Existenz von Aminosäuren wie Selenomethionin entdeckt.
Physikalische und chemische Eigenschaften
Aussehen
Da es für Selen mehrere Allotrope gibt, variiert sein physikalisches Erscheinungsbild. Tritt normalerweise als rötlicher Feststoff in Pulverform auf.
Standardatomgewicht
78.971 u
Ordnungszahl (Z)
3. 4
Schmelzpunkt
221 ºC
Siedepunkt
685 ºC
Dichte
Die Dichte von Selen variiert in Abhängigkeit davon, welches Allotrop oder Polymorph betrachtet wird. Einige seiner bei Raumtemperatur bestimmten Dichten sind:
Grau: 4,819 g / cm3
Alpha: 4,39 g / cm3
Glas: 4,28 g / cm3
Flüssiger Zustand (Schmelzpunkt): 3,99 g / cm3
Schmelzwärme
Grau: 6,69 kJ / mol
Verdampfungswärme
95,48 kJ / mol
Molare Wärmekapazität
25,363 J / (mol K)
Oxidationszahlen
Selen kann in seinen Verbindungen binden und die folgenden Zahlen oder Oxidationsstufen aufweisen: -2, -1, +1, +2, +3, +4, +5, +6. Unter allen sind die wichtigsten -2 (Sezwei-), +4 (Se4+) und +6 (Se6+).
Zum Beispiel in der SeOzwei Selen hat eine Oxidationszahl von +4; das heißt, die Existenz des Kations Se wird angenommen4+ (Ich weiß4+ODERzweizwei-). Ähnliches gilt für SeO3 Selen hat eine Oxidationszahl von +6 (Se6+ODER3zwei-).
In Wasserstoffselenid ist H.zweiSe, Selen hat eine Oxidationszahl von -2; das heißt wiederum wird die Existenz des Ions oder Anions Se angenommenzwei- (H.zwei+ich weißzwei-). Dies liegt daran, dass Selen elektronegativer als Wasserstoff ist..
Elektronegativität
2,55 auf der Pauling-Skala.
Ionisationsenergie
-Erstens: 941 kJ / mol.
-Zweitens: 2.045 kJ / mol.
-Drittens: 2.973,7 kJ / mol.
Magnetische Ordnung
Diamagnetisch.
Härte
2,0 auf der Mohs-Skala.
Isotope
Es gibt fünf natürliche und stabile Isotope von Selen, die unten mit ihren jeweiligen Häufigkeiten gezeigt werden:
-74Se (0,86%)
-76Se (9,23%)
-77Se (7,6%)
-78Se (23,69%)
-80Se (49,8%)
Allotropie

Bei chemischen Reaktionen hergestelltes Selen ist ein ziegelrotes amorphes Pulver, das beim schnellen Schmelzen ähnlich wie Rosenkranzperlen zur glasigen schwarzen Form führt (oberes Bild). Schwarzes Selen ist ein spröder und glänzender Feststoff.
Schwarzes Selen ist auch in Schwefelkohlenstoff schwer löslich. Wenn diese Lösung auf 180 ° C erhitzt wird, fällt graues Selen aus, sein stabilstes und dichtestes Allotrop..
Graues Selen ist oxidationsbeständig und gegenüber der Einwirkung nicht oxidierender Säuren inert. Die Haupteigenschaft dieses Selens ist seine Photoleitfähigkeit. Bei Beleuchtung erhöht sich die elektrische Leitfähigkeit um das 10- bis 15-fache.
Reaktivität
Selen in seinen Verbindungen liegt in den Oxidationsstufen -2, +4 und +6 vor. Es zeigt eine deutliche Tendenz zur Bildung von Säuren in den höheren Oxidationsstufen. Verbindungen mit Selen mit Oxidationsstufe -2 werden Selenide genannt (Sezwei-).
Reaktion mit Wasserstoff
Selen reagiert mit Wasserstoff unter Bildung von Selenwasserstoff (H.zweiSe), ein farbloses, brennbares und übelriechendes Gas.
Reaktion mit Sauerstoff
Selen verbrennt, strahlt eine blaue Flamme aus und bildet Selendioxid:
ich weiß8 (s) + 8 O.zwei => 8 SeOzwei (s)
Selenoxid ist eine feste, weiße polymere Substanz. Seine Hydratation produziert selenhaltige Säure (H.zweiSeO3). Auch Selen bildet Selentrioxid (SeO)3), analog zu Schwefel (SO3).
Reaktion mit Halogenen
Selen reagiert mit Fluor unter Bildung von Selenhexafluorid:
ich weiß8 (s) + 24 F.zwei (g) => 8 SeF6 (l)
Selen reagiert mit Chlor und Brom unter Bildung von Disileniumdichlorid bzw. Dibromid:
ich weiß8 (s) + 4 Clzwei => 4 SezweiClzwei
ich weiß8 (s) + 4 Brzwei => 4 SezweiBrzwei
Selen kann auch SeF bilden4 und SeCl4.
Andererseits bildet Selen Verbindungen, in denen sich ein Selenatom mit einem von Halogen und einem anderen von Sauerstoff verbindet. Ein wichtiges Beispiel ist Selenoxychlorid (SeO)zweiClzwei), mit Selen in Oxidationsstufe +6, einem extrem starken Lösungsmittel.
Reaktion mit Metallen
Selen reagiert mit Metallen unter Bildung von Seleniden aus Aluminium, Cadmium und Natrium. Die folgende chemische Gleichung entspricht der für die Bildung von Aluminiumselenid:
3 Se8 + 16 Al => 8 Alzweiich weiß3
Selenite
Selen bildet Salze, die als Selenite bekannt sind; zum Beispiel: Silberselenit (AgzweiSeO3) und Natriumselenit (NazweiSeO3). Dieser Name wurde in einem literarischen Kontext verwendet, um sich auf Bewohner des Mondes zu beziehen: die Seleniten.
Säuren
Die wichtigste Säure in Selen ist Selensäure (H.zweiSeO4). Es ist so stark wie Schwefelsäure und lässt sich leichter reduzieren.
Struktur und elektronische Konfiguration
- Selen und seine Verbindungen
Selen hat sechs Valenzelektronen, weshalb es sich in Gruppe 16 befindet, genau wie Sauerstoff und Schwefel. Diese sechs Elektronen befinden sich entsprechend ihrer elektronischen Konfiguration in den 4s- und 4p-Orbitalen:
[Ar] 3d10 4szwei 4p4
Es muss daher wie Schwefel zwei kovalente Bindungen bilden, um sein Valenzoktett zu vervollständigen. obwohl es die Verfügbarkeit seiner 4d-Orbitale hat, um sich mit mehr als zwei Atomen zu verbinden. Somit kommen drei Selenatome zusammen und bilden zwei kovalente Bindungen: Se-Se-Se.
Selen mit seiner höchsten Atommasse neigt von Natur aus dazu, Strukturen zu bilden, die von kovalenten Bindungen bestimmt werden. anstatt als zweiatomige Moleküle angeordnet zu sein Sezwei, Se = Se, analog zu O.zwei, O = O..
- Ringe oder Ketten
Unter den molekularen Strukturen, die Selenatome annehmen, können zwei allgemein erwähnt werden: Ringe oder Ketten. Beachten Sie, dass im hypothetischen Fall von Se3, Die Se-Atome an den Enden benötigen noch Elektronen. Daher müssen sie nacheinander an andere Atome gebunden werden, bis die Kette zu einem Ring geschlossen werden kann.
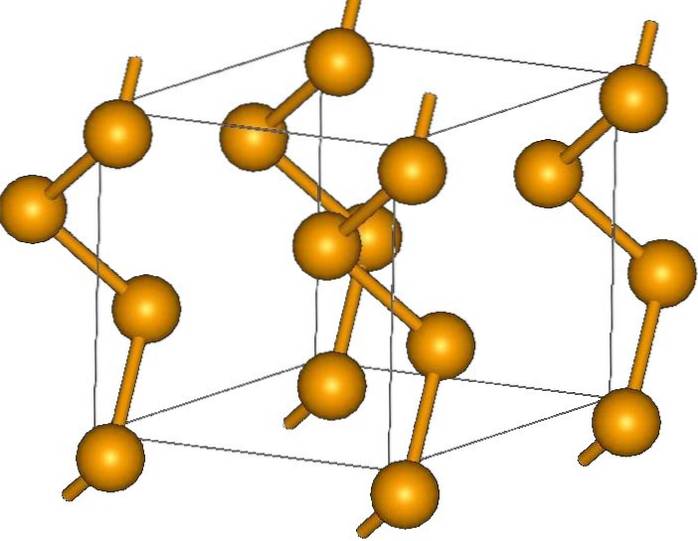
Die häufigsten Ringe sind die achtgliedrigen Ringe oder Selenatome:8 (eine Selenitkrone). Warum acht? Denn je kleiner der Ring ist, desto mehr Stress wird er erleiden. Das heißt, die Winkel ihrer Bindungen weichen von den natürlichen Werten ab, die durch ihre sp-Hybridisierungen festgelegt werden3 (ähnlich wie bei Cycloalkanen).
Da es acht Atome gibt, ist die Trennung zwischen den Se-Se-Atomen ausreichend, so dass ihre Bindungen "entspannt" und nicht "gebogen" sind; obwohl der Winkel seiner Verbindungen 105,7º und nicht 109,5º beträgt. Andererseits kann es kleinere Ringe geben:6 und7.
Das obere Bild zeigt die Se ring-Einheiten.8. Beachten Sie die Ähnlichkeit mit den Schwefelkronen; nur sie sind größer und schwerer.
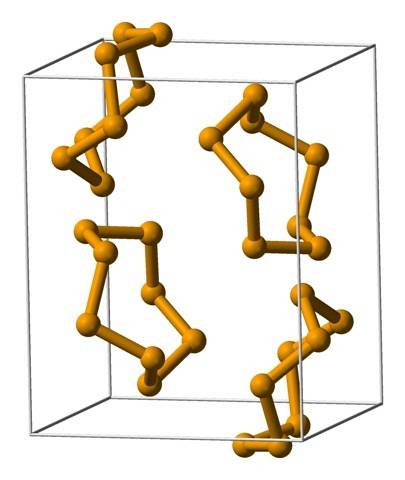
Neben Ringen können Selenatome auch in spiralförmigen Ketten angeordnet sein (denken Sie an Wendeltreppen):
An seinen Enden können terminale Doppelbindungen (-Se = Se) oder Se-Ringe vorhanden sein8.
- Allotrope
Unter Berücksichtigung der Tatsache, dass es helikale Ringe oder Selenketten geben kann und dass ihre Abmessungen auch in Abhängigkeit von der Anzahl der enthaltenen Atome variieren können, ist es offensichtlich, dass es für dieses Element mehr als ein Allotrop gibt. das heißt, reine Selenfeststoffe, aber mit unterschiedlichen Molekülstrukturen.
Rotes Selen
Unter den bekanntesten Allotropen von Selen haben wir Rot, das als amorphes Pulver oder als monokline und polymorphe Kristalle auftreten kann (siehe Bild von Se8).
In amorphem rotem Selen sind die Strukturen ungeordnet, ohne erkennbare Muster; Während in der Linse die Ringe eine monokline Struktur bilden. Rotes kristallines Selen ist polymorph und hat drei Phasen: α, β und γ, die sich in ihrer Dichte unterscheiden..
Schwarzes Selen
Die Struktur von schwarzem Selen besteht ebenfalls aus Ringen; aber nicht von acht Mitgliedern, sondern von vielen weiteren, die bis zu Ringen mit tausend Atomen reichen (Se1000). Es wird dann gesagt, dass seine Struktur komplex ist und aus Polymerringen besteht; einige größer oder kleiner als andere.
Da es Polymerringe unterschiedlicher Größe gibt, ist es schwierig zu erwarten, dass sie eine strukturelle Ordnung herstellen. so ist das schwarze Selen auch amorph, aber im Gegensatz zu dem oben erwähnten rötlichen Pulver hat es glasartige Texturen, obwohl es spröde ist.
Graues Selen
Und schließlich ist eines der einfachsten Allotrope von Selen grau, das sich von den anderen abhebt, da es unter normalen Bedingungen am stabilsten ist und auch ein metallisches Aussehen hat..
Seine Kristalle können hexagonal oder trigonal sein, was durch die Londoner Dispersionskräfte zwischen seinen polymeren Helixketten entsteht (oberes Bild). Der Winkel ihrer Bindungen beträgt 130,1º, was eine positive Abweichung von der tetraedrischen Umgebung anzeigt (mit Winkeln von 109,5º)..
Deshalb erwecken Selen-Helixketten den Eindruck, "offen" zu sein. Zur Aufklärung stehen sich in dieser Struktur die Atome gegenüber, so dass theoretisch eine größere Überlappung ihrer Orbitale auftreten muss, um Leitungsbänder zu erzeugen.
Die Hitze mit der Zunahme der molekularen Schwingungen beschädigt diese Banden, wenn die Ketten ungeordnet werden; während die Energie eines Photons die Elektronen direkt beeinflusst, sie anregt und ihre Transaktionen fördert. Unter diesem Gesichtspunkt ist die Photoleitfähigkeit von grauem Selen „leicht“ vorstellbar..
Wo es sich befindet und Produktion
Obwohl weit verbreitet, ist Selen ein seltenes Element. Es befindet sich in seinem ursprünglichen Zustand in Verbindung mit Schwefel und Mineralien wie Eukairit (CuAgSe), Klaustalit (PbSe) und Naumanit (AgzweiSe) und Crookesit [(CuTiAg)zweiIch weiß].
Selen wird als Verunreinigung gefunden, die Schwefel in einem kleinen Teil der schwefelhaltigen Mineralien von Metallen ersetzt. wie Kupfer, Blei, Silber usw..
Es gibt Böden, in denen Selen in löslicher Form von Selenaten vorliegt. Diese werden vom Regenwasser zu den Flüssen und von dort zum Meer transportiert.
Einige Pflanzen können Selen aufnehmen und konzentrieren. Zum Beispiel enthält eine Tasse Paranüsse 544 µg Selen, eine Menge, die 777% der täglich empfohlenen Menge Selen entspricht..
Bei Lebewesen kommt Selen in einigen Aminosäuren vor, wie zum Beispiel: Selenomethionin, Selenocystein und Methylselenocystein. Selenocystein und Selenit werden zu Selenwasserstoff reduziert.
Elektrolyse von Kupfer
Es wird kein Selen abgebaut. Das meiste davon entsteht als Nebenprodukt des Kupferelektrolyse-Raffinierungsprozesses, der sich im Schlick befindet, der sich an der Anode ansammelt..
Der erste Schritt ist die Herstellung von Selendioxid. Hierzu wird der anodische Schlick mit Natriumcarbonat behandelt, um seine Oxidation zu erzeugen. Dann wird Wasser zu Selenoxid gegeben und es wird angesäuert, um Selensäure zu bilden..
Schließlich wird Selensäure mit Schwefeldioxid behandelt, um es zu reduzieren und elementares Selen zu erhalten..
Bei einem anderen Verfahren in der bei der Herstellung von Schwefelsäure gebildeten Mischung aus Schlick und Schlamm wird ein unreines rotes Selen erhalten, das sich in Schwefelsäure löst..
Dann werden Selensäure und Selensäure gebildet. Diese Selensäure wird genauso behandelt wie das vorherige Verfahren.
Chlor, das auf Metallselenide wirkt, kann auch zur Herstellung flüchtiger chlorierter Selenverbindungen verwendet werden. wie zum Beispiel: SezweiClzwei, SeCl4, SeClzwei und SeOClzwei.
Diese Verbindungen werden in einem in Wasser durchgeführten Verfahren in Selensäure umgewandelt, die mit Schwefeldioxid behandelt wird, um das Selen freizusetzen..
Biologische Rolle
Mangel
Selen ist ein essentielles Spurenelement für Pflanzen und Tiere, deren Mangel beim Menschen schwerwiegende Störungen wie die Keshan-Krankheit verursacht hat. eine Krankheit, die durch eine Schädigung des Myokards gekennzeichnet ist.
Darüber hinaus ist Selenmangel mit männlicher Unfruchtbarkeit verbunden und kann bei der Kashin-Beck-Krankheit, einer Art von Arthrose, eine Rolle spielen. Auch bei rheumatoider Arthritis wurde ein Selenmangel beobachtet.
Enzym-Cofaktor
Selen ist ein Bestandteil von Enzymen mit antioxidativer Wirkung wie Glutathionperoxidase und Thioredoxinreduktase, die Substanzen mit reaktivem Sauerstoff eliminieren..
Darüber hinaus ist Selen ein Cofaktor der Schilddrüsenhormon-Deiodinasen. Diese Enzyme sind wichtig für die Regulierung der Funktion von Schilddrüsenhormonen..
Über die Verwendung von Selen bei der Behandlung der Hasimoto-Krankheit, einer Autoimmunerkrankung mit Bildung von Antikörpern gegen Schilddrüsenzellen, wurde berichtet.
Selen wurde auch verwendet, um die toxischen Wirkungen von Quecksilber zu verringern, da einige seiner Wirkungen auf selenabhängige antioxidative Enzyme ausgeübt werden.
Proteine und Aminosäuren
Der Mensch hat etwa 25 Selenoproteine, die eine antioxidative Wirkung zum Schutz vor oxidativem Stress ausüben, die durch einen Überschuss an reaktiven Sauerstoffspezies (ROS) und reaktiven Stickstoffspezies (NOS) ausgelöst wird..
Das Vorhandensein der Aminosäuren Selenomethiocin und Selenocystein wurde beim Menschen nachgewiesen. Selenomethionin wird als Nahrungsergänzungsmittel bei der Behandlung von Selenmangelzuständen eingesetzt.
Risiken
Eine hohe Körperkonzentration an Selen kann zahlreiche gesundheitsschädliche Auswirkungen haben, angefangen bei brüchigem Haar und brüchigen Nägeln bis hin zu Hautausschlägen, Hitze, Hautödemen und starken Schmerzen.
Bei der Behandlung von Selen in Kontakt mit den Augen können Brennen, Reizungen und Tränen auftreten. Währenddessen kann eine längere Exposition gegenüber Rauch mit hohem Selengehalt Lungenödeme, Knoblauchatem und Bronchitis verursachen..
Darüber hinaus kann die Person unter Lungenentzündung, Übelkeit, Schüttelfrost, Fieber, Halsschmerzen, Durchfall und Hepatomegalie leiden..
Selen kann mit anderen Arzneimitteln und Nahrungsergänzungsmitteln wie Antazida, Antineoplastika, Kortikosteroiden, Niacin und Antibabypillen interagieren..
Selen wurde mit einem erhöhten Hautkrebsrisiko in Verbindung gebracht. Eine Studie des National Cancer Institute ergab, dass Männer mit einem hohen Selengehalt im Körper doppelt so häufig an aggressivem Prostatakrebs leiden.
Eine Studie zeigt, dass die tägliche Einnahme von 200 µg Selen die Wahrscheinlichkeit, an Typ-II-Diabetes zu erkranken, um 50% erhöht.
Anwendungen
Kosmetika
Selensulfid wird zur Behandlung von Seborrhoe sowie von fettigem oder schuppigem Haar verwendet.
Ärzte
Es wird als alternative Medizin bei der Behandlung der Hasimoto-Krankheit, einer Autoimmunerkrankung der Schilddrüse, eingesetzt.
Selen verringert die Toxizität von Quecksilber. Eine seiner toxischen Aktivitäten wird auf desoxidierende Enzyme ausgeübt, die Selen als Cofaktor verwenden.
Manganelektrolyse
Die Verwendung von Selenoxid bei der Elektrolyse von Mangan reduziert die Kosten der Technik erheblich, da sie den Stromverbrauch senkt.
Pigment
Selen wird als Pigment in Farben, Kunststoffen, Keramiken und Glas verwendet. Je nach verwendetem Selen variiert die Farbe des Glases von tiefrot bis hellorange..
Fotoleitend
Aufgrund der Eigenschaft von grauem Selen, seine elektrische Leitfähigkeit in Abhängigkeit von der Intensität des Lichts, das es ausstrahlt, zu ändern, wurde Selen in Fotokopierern, Fotozellen, Photometern und Solarzellen verwendet.
Die Verwendung von Selen in Fotokopierern war eine der Hauptanwendungen von Selen; Das Auftreten von organischen Fotoleitern hat jedoch ihre Verwendung verringert.
Kristalle
Selen wird zur Verfärbung von Gläsern verwendet, da Eisen vorhanden ist, das eine grüne oder gelbe Färbung erzeugt. Darüber hinaus ermöglicht es eine rote Färbung des Glases, abhängig von der Verwendung, die Sie ihm geben möchten..
Vulkanisation
Diethyldithiocarbonat-Selen wird als Vulkanisationsmittel in Gummiprodukten verwendet.
Legierungen
Selen wird in Kombination mit Wismut in Messing verwendet, um Blei zu ersetzen. Sehr giftiges Element, das aufgrund der Empfehlungen von Gesundheitsorganisationen weniger verwendet wird.
Selen wird Stahl- und Kupferlegierungen in geringen Konzentrationen zugesetzt, um die Verwendbarkeit dieser Metalle zu verbessern..
Gleichrichter
Selengleichrichter wurden 1933 bis in die 1970er Jahre eingesetzt, als sie aufgrund ihrer geringen Kosten und ihrer überlegenen Qualität durch Silizium ersetzt wurden..
Verweise
- Royal Australian Chemical Institute. (2011). Selen. [PDF]. Wiederhergestellt von: raci.org.au
- Wikipedia. (2019). Selen. Wiederhergestellt von: en.wikipedia.org
- Sato Kentaro. (s.f.). Neue Allotrope der Hauptgruppenelemente. [PDF]. Wiederhergestellt von: tcichemicals.com
- Dr. Dough Stewart. (2019). Fakten zu Selenelementen. Chemicool. Wiederhergestellt von: chemicool.com
- Robert C. Brasted. (28. August 2019). Selen. Encyclopædia Britannica. Wiederhergestellt von: britannica.com
- Marques Miguel. (s.f.). Selen. Wiederhergestellt von: nautilus.fis.uc.pt
- Helmenstine, Anne Marie, Ph.D. (3. Juli 2019). Selen Fakten. Wiederhergestellt von :oughtco.com
- Lenntech B. V. (2019). Periodensystem: Selen. Wiederhergestellt von: lenntech.com
- Tinggi U. (2008). Selen: seine Rolle als Antioxidans für die menschliche Gesundheit. Umweltgesundheit und Präventivmedizin, 13(2), 102 & ndash; 108. doi: 10.1007 / s12199-007-0019-4
- Büro für Nahrungsergänzungsmittel. (9. Juli 2019). Selen: Informationsblatt für Angehörige der Gesundheitsberufe. Nationales Institut für Gesundheit. Wiederhergestellt von: ods.od.nih.gov



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.