
Kohlenstoff-Allotrope amorpher Kohlenstoff, Graphit, Graphene, Nanoröhren

Das Kohlenstoff-Allotrope Sie sind die verschiedenen physikalischen Formen, in denen ihre Atome angeordnet und verbunden werden können. Jeder entspricht einem Festkörper mit seinen eigenen Besonderheiten. Molekular und strukturell unterscheiden sie sich voneinander. Es gibt zwei Haupttypen dieser Allotrope: kristallin und amorph..
Kristalline Allotrope sind solche, die ein sich wiederholendes Muster ihrer Atome im Raum aufweisen. Währenddessen sind in amorphen Allotropen die Atome ungeordnet angeordnet, ohne dass zwei identische Regionen im Festkörper vorhanden sind. Also sind die ersten bestellt und die zweiten chaotisch.
(https://creativecommons.org/licenses/by-sa/4.0)]
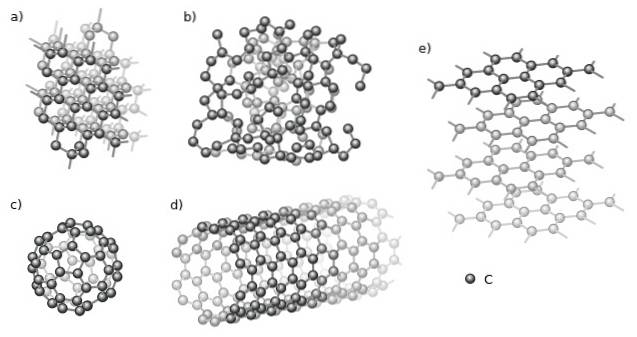
Unter den kristallinen befinden sich Diamant (a) und Graphit (e) schlechthin. Im oberen Bild sind verschiedene Strukturen zu sehen, die einen gemeinsamen Aspekt haben: Sie bestehen nur aus Kohlenstoffatomen (schwarze Kugeln)..
Und unter den amorphen Allotropen haben wir den amorphen Kohlenstoff (b), dessen Struktur, wie zu sehen ist, ungeordnet ist. Es gibt jedoch viele Arten von amorphen Kohlenstoffen, so dass es sich um eine Familie von Feststoffen handelt..
Kohlenstoffatome können auch Supramoleküle wie Fullerene (c) und Nanoröhren (d) bilden. Diese Supramoleküle können in Größe und Form variieren, behalten jedoch die gleichen Geometrien bei; kugelförmig und röhrenförmig für Fullerene bzw. Nanoröhren.
Artikelverzeichnis
- 1 Kovalente Kohlenstoffbindungen
- 1.1 Sechsecke
- 1.2 Tetraeder
- 2 Amorpher Kohlenstoff
- 2.1 Politismus
- 2.2 Funktionsgruppen
- 3 Graphit
- 3.1 Physikalische Eigenschaften
- 4 Graphene
- 5 Kohlenstoffnanoröhren
- 5.1 Strukturelle Konformationen
- 6 Fullerene
- 7 Referenzen
Kovalente Kohlenstoffbindungen
Bevor auf einige der bekannten Allotrope von Kohlenstoff eingegangen wird, muss überprüft werden, wie sich Kohlenstoffatome verbinden..
Nach der Valenzbindungstheorie hat Kohlenstoff vier Elektronen in seiner Valenzschale, mit denen sie kovalente Bindungen bilden. Dank elektronischer Förderung und Hybridisierung können die vier Elektronen in vier getrennten Orbitalen platziert werden, sei es rein oder hybrid.
Daher kann Kohlenstoff bis zu vier Bindungen bilden.
DC. Durch vier CC-Bindungen erreichen die Atome das Valenzoktett und werden sehr stabil. Dies bedeutet jedoch nicht, dass es nicht nur drei dieser Links geben kann, wie sie beispielsweise in Sechsecken zu sehen sind..
Sechsecke
Abhängig von den Hybridisierungen des Kohlenstoffatoms können Doppel- oder Dreifachbindungen in der Struktur ihrer jeweiligen Allotrope gefunden werden. Noch offensichtlicher als die Existenz solcher Bindungen ist jedoch die Geometrie, die die Kohlenstoffe annehmen.
Wenn zum Beispiel ein Sechseck beobachtet wird, bedeutet dies, dass die Kohlenstoffe eine sp-Hybridisierung aufweisenzwei und haben daher ein Orbital p rein mit einem einsamen Elektron. Können Sie im ersten Bild perfekte Sechsecke sehen? Diese Allotrope, die sie enthalten, implizieren, dass ihre Kohlenstoffe sp sindzwei, ob es Doppelbindungen gibt oder nicht (wie die des Benzolrings).
Eine Maschen-, Ebenen- oder Sechseckschicht besteht dann aus sp-Kohlenstoffenzwei das hat eine elektronische "Decke" oder "Wolke", Produkt des ungepaarten Elektrons des Orbitals p. Dieses Elektron kann kovalente Bindungen mit anderen Molekülen eingehen oder die positiven Ladungen von Metallionen anziehen. wie der K.+ und Na+.
Ebenso ermöglichen diese Elektronen, dass diese Schalen ohne Bindung übereinander gestapelt werden (aufgrund eines geometrischen und räumlichen Hindernisses für die Überlappung der beiden Orbitale p). Dies bedeutet, dass Allotrope mit hexagonalen Geometrien zum Aufbau eines Kristalls angeordnet werden können oder nicht..
Tetraeder
Wenn ein Tetraeder beobachtet wird, wie im letzten Abschnitt erläutert wird, bedeutet dies, dass die Kohlenstoffe eine sp-Hybridisierung aufweisen3. In ihnen befinden sich vier einfache C-C-Bindungen, die ein tetraedrisches Kristallgitter bilden. In solchen Tetraedern gibt es keine freien Elektronen wie in Sechsecken..
Amorpher Kohlenstoff

Amorpher Kohlenstoff kann als eine Art poröser Schwamm mit vielen willkürlich angeordneten hexagonalen und tetraedrischen Netzwerken vorgestellt werden. In dieser Mineralmatrix können sie andere Elemente einfangen, die den Schwamm verdichten oder ausdehnen können; und auf die gleiche Weise können seine Strukturkerne größer oder kleiner sein.
So werden abhängig vom prozentualen Kohlenstoffgehalt verschiedene Arten von amorphen Kohlenstoffen abgeleitet; wie Ruß, Holzkohle, Anthrazit, Ruß, Torf, Koks und Aktivkohle.
Auf den ersten Blick sehen sie alle aus der Ferne ähnlich aus (oberes Bild), mit Abstufungen bis zum Rand schwarzer, stumpfer oder metallischer und grauer Obertöne..
Nicht alle amorphen Kohlenstoffe haben den gleichen Ursprung. Pflanzlicher Kohlenstoff ist, wie der Name schon sagt, das Produkt der Verbrennung von Gemüsemassen und Holz. Während Ruß und Koks Produkte verschiedener Stadien und Bedingungen von Erdölprozessen sind..
Obwohl sie nicht sehr attraktiv erscheinen und angenommen werden kann, dass sie nur als Brennstoffe dienen, ziehen die Porositäten ihrer Feststoffe bei technologischen Reinigungsanwendungen wie der Lagerung von Absorptionsmitteln und Substanzen sowie als katalytische Träger die Aufmerksamkeit auf sich..
Politypismus
Die Strukturen amorpher Kohlenstoffe sind komplex und ungeordnet; Kristallographische Studien haben jedoch gezeigt, dass es sich in Wirklichkeit um tetraedrische (Diamant) und hexagonale (Graphit) Polytypen handelt, die willkürlich in Schichten angeordnet sind.
Wenn beispielsweise T und H die tetraedrischen bzw. hexagonalen Schichten sind, kann ein amorpher Kohlenstoff strukturell beschrieben werden als: THTHHTH; oder HTHTTHTHHHT usw. Bestimmte T- und H-Schichtsequenzen definieren eine Art von amorphem Kohlenstoff; aber in ihnen gibt es keinen sich wiederholenden Trend oder Muster.
Aus diesem Grund ist es strukturell schwierig, diese Kohlenstoff-Allotrope zu charakterisieren. und stattdessen wird sein Kohlenstoffanteil bevorzugt, der eine Variable ist, die seine Unterschiede zusätzlich zu seinen physikalischen Eigenschaften und seiner Neigung zum Verbrennen oder Verbrennen erleichtert.
Funktionelle Gruppen
Es wurde erwähnt, dass hexagonale Ebenen ein ungepaartes Elektron haben, mit dem sie eine Bindung mit anderen Molekülen oder Atomen eingehen können. Wenn zum Beispiel die umgebenden Moleküle das H sindzweiO und COzwei, Es ist zu erwarten, dass sich OH- bzw. COOH-Gruppen bilden. Sie können auch an Wasserstoffatome binden und CH-Bindungen bilden..
Die Möglichkeiten sind sehr vielfältig, aber zusammenfassend können amorphe Kohlenstoffe sauerstoffhaltige funktionelle Gruppen enthalten. Wenn diese Heteroatome vorhanden sind, befinden sie sich nicht nur an den Rändern der Ebenen, sondern auch und sogar im Inneren.
Graphit

Das Bild oben zeigt ein Modell mit Kugeln und Strings der Kristallstruktur von Graphit. Glücklicherweise helfen die Schatten der Kugeln, die π-Wolken als Ergebnis der Delokalisierung ihrer ungepaarten Elektronen sichtbar zu machen. Dies wurde im ersten Abschnitt ohne so viele Details erwähnt.
Diese π-Wolken können mit zwei Systemen verglichen werden: dem von Benzolringen und dem von "Elektronenmeeren" in Metallkristallen..
Orbitale p sie verbinden sich, um eine Spur zu bauen, auf der sich Elektronen frei bewegen können; aber nur zwischen zwei sechseckigen Schichten; senkrecht zu ihnen gibt es keinen Elektronenfluss oder Stromfluss (die Elektronen müssten durch die Kohlenstoffatome passieren).
Da es eine konstante Elektronenwanderung gibt, werden ständig augenblickliche Dipole gebildet, die andere Dipole von Kohlenstoffatomen induzieren, die oben oder unten liegen; Das heißt, die Schichten oder Schichten aus Graphit bleiben dank der Londoner Dispersionskräfte zusammen..
Diese hexagonalen Schichten erzeugen erwartungsgemäß einen hexagonalen Graphitkristall; oder vielmehr eine Reihe kleiner Kristalle, die unter verschiedenen Winkeln verbunden sind. Die π-Wolken verhalten sich wie eine "elektrische Butter", so dass die Schichten vor jeder äußeren Störung der Kristalle gleiten können.
Physikalische Eigenschaften
Die physikalischen Eigenschaften von Graphit sind leicht zu verstehen, sobald seine molekulare Struktur untersucht wurde..
Beispielsweise ist der Schmelzpunkt von Graphit sehr hoch (über 4400 ° C), da die in Form von Wärme zugeführte Energie die hexagonalen Schichten irreversibel trennen und auch ihre Sechsecke brechen muss..
Es wurde nur gesagt, dass ihre Schichten übereinander gleiten können; Und nicht nur, sondern sie können auch auf anderen Oberflächen landen, beispielsweise auf der Zellulose, aus der das Papier besteht, wenn es aus dem Graphit der Stifte abgelagert wird. Diese Eigenschaft ermöglicht es Graphit, als ausgezeichnetes Schmiermittel zu wirken..
Und wie bereits erwähnt, ist es ein guter Leiter für Elektrizität sowie für Wärme und Schall..
Graphene

Obwohl es im ersten Bild nicht gezeigt wurde, kann dieses Kohlenstoff-Allotrop nicht ausgelassen werden. Angenommen, die Graphitschichten wurden erfasst und zu einer einzigen Folie verdichtet, die offen war und eine große Fläche bedeckte. Wenn dies molekular geschehen würde, würden Graphene geboren (oberes Bild).
Graphen ist also eine einzelne Graphitschicht, die nicht mit anderen interagiert und wie eine Flagge winken kann. Beachten Sie, dass es Ähnlichkeit mit den Wänden der Bienenwaben hat.
Diese Graphenschichten bewahren und vervielfachen die Eigenschaften von Graphit. Seine Sechsecke sind sehr schwer zu trennen, weshalb sie einen abgrundtiefen mechanischen Widerstand aufweisen. noch höher als Stahl. Außerdem sind sie extrem leicht und dünn, und theoretisch würde ein Gramm davon ausreichen, um ein ganzes Fußballfeld zu bedecken..
Wenn Sie sich das obere Bild noch einmal ansehen, sehen Sie, dass es keine Doppelbindungen gibt. Sicherlich kann es sie geben, sowie Dreifachbindungen (Graffine). Hier öffnet sich beispielsweise die Chemie des Graphens.
Wie Graphit und die anderen hexagonalen Schichten können andere Moleküle kovalent an die Oberfläche von Graphen binden und dessen Struktur für elektronische und biologische Anwendungen funktionalisieren..
Kohlenstoff-Nanoröhren
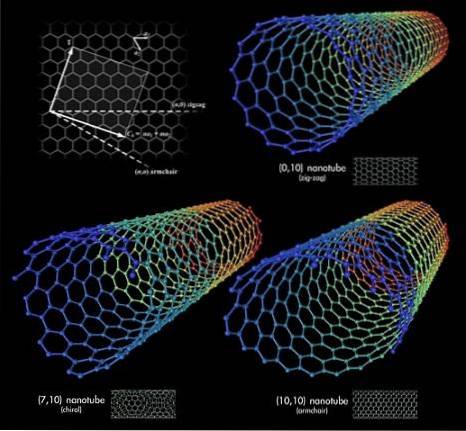
Nehmen wir nun an, wir packten die Graphenschichten und rollten sie in eine Röhre. Dies sind die Kohlenstoffnanoröhren. Die Längen und der Radius dieser Rohre sind variabel, ebenso wie ihre räumlichen Konformationen. Zusammen mit Graphen und Fullerenen bilden diese Nanoröhren die Triade der überraschendsten Kohlenstoff-Allotrope.
Strukturelle Konformationen
Im oberen Bild sind drei Kohlenstoffnanoröhren dargestellt. Was ist der Unterschied zwischen ihnen? Alle drei haben sechseckig gemusterte Wände und weisen die gleichen Oberflächeneigenschaften auf, die bereits diskutiert wurden. Die Antwort liegt dann in den relativen Orientierungen dieser Sechsecke.
Die erste Konformation entspricht dem Zickzack-Typ (obere rechte Ecke). Wenn Sie genau hinschauen, werden Sie feststellen, dass Sechseckreihen perfekt senkrecht zur Längsachse des Rohrs positioniert sind..
Im Gegensatz dazu für die Typkonformation Sessel, oder Stuhl (untere rechte Ecke) sind die Sechsecke in Reihen in der gleichen Richtung wie die Längsachse des Rohrs angeordnet. In der ersten Nanoröhre verlaufen die Sechsecke im Sinne ihres Durchmessers über die Oberfläche, und in der zweiten Nanoröhre verlaufen sie entlang der Oberfläche von „Ende zu Ende“..
Und schließlich gibt es die chirale Nanoröhre (untere linke Ecke). Vergleichen Sie eine Wendeltreppe nach links oder rechts. Dasselbe passiert mit dieser Kohlenstoffnanoröhre: Ihre Sechsecke sind nach links oder rechts aufsteigend angeordnet. Da es zwei räumliche Versionen gibt, wird gesagt, dass es Chiralität zeigt.
Fullerene
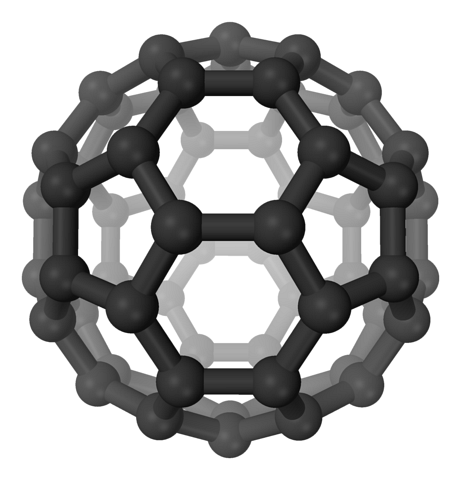
In den Fullerenen bleiben die Sechsecke erhalten, aber zusätzlich erscheinen die Fünfecke, alle mit sp-Kohlenstoffenzwei. Die Blätter oder Schichten sind bereits zurückgeblieben: Jetzt wurden sie so gefaltet, dass sie einen Ball bilden, ähnlich einem Fußball; und je nach Anzahl der Kohlenstoffe zu einem Rugbyball.
Fullerene sind Moleküle, die sich in der Größe unterscheiden. Das bekannteste ist das C.60 (oberes Bild). Diese Kohlenstoff-Allotrope sollten als Ballons behandelt werden, die sich zu Kristallen zusammendrücken können, in denen Ionen und andere Moleküle in ihren Zwischenräumen eingeschlossen werden können..
Diese Kugeln sind spezielle Träger oder Träger für Moleküle. Wie? Durch die kovalenten Bindungen an seine Oberfläche, insbesondere an die benachbarten Kohlenstoffe eines Sechsecks. Das Fulleren soll dann funktionalisiert worden sein (ein exohedrales Addukt).
Seine Wände können strategisch zerbrochen werden, um Moleküle darin zu speichern. ähnlich einer kugelförmigen Kapsel. Diese Kugeln können auch Risse aufweisen und gleichzeitig funktionalisiert werden. Alles hängt von der Anwendung ab, für die sie bestimmt sind.
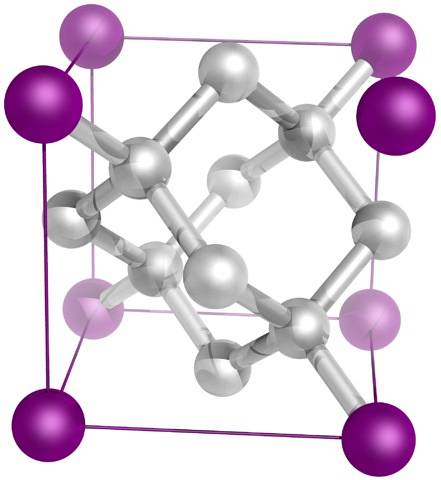
Und schließlich das bekannteste aller Allotrope von Kohlenstoff: Diamant (obwohl nicht alle Kohlenstoff sind).
Strukturell besteht es aus Kohlenstoffatomen sp3, Bildung von vier CC-Bindungen und eines dreidimensionalen Netzwerks von Tetraedern (oberes Bild), deren kristalline Zelle kubisch ist. Es ist das härteste Mineral und hat einen Schmelzpunkt nahe 4000 ° C..
Seine Tetraeder sind in der Lage, Wärme effizient durch das Kristallgitter zu übertragen. aber nicht so bei Elektrizität, weil ihre Elektronen sehr gut in ihren vier kovalenten Bindungen lokalisiert sind und er nirgendwo hingehen kann. Daher ist es ein guter Wärmeleiter, aber es ist ein elektrischer Isolator..
Je nachdem, wie facettiert es ist, kann es Licht in vielen hellen und attraktiven Winkeln streuen, weshalb sie als Edelsteine und Schmuck begehrt sind..
Das Netzwerk ist sehr widerstandsfähig, da es viel Druck benötigen würde, um seine Tetraeder zu bewegen. Diese Eigenschaft macht es zu einem Material mit hoher mechanischer Beständigkeit und Härte, das wie beim Skalpell mit Diamantspitze präzise und saubere Schnitte ausführen kann..
Ihre Farben hängen von ihren kristallographischen Defekten und ihren Verunreinigungen ab.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Méndez Medrano, Ma. Guadalupe, Rosu, H.C., Torres González, L.A. (2012). Graphen: das vielversprechendste Allotrop von Kohlenstoff. Universitätsgesetz. vol. 22, nein. 3, April-Mai 2012, pp. 20-23, Universität von Guanajuato, Guanajuato, Mexiko.
- IES La Magdalena. Aviles. Asturien. (s.f.). Allotrope Formen von Kohlenstoff. [PDF]. Wiederhergestellt von: fisquiweb.es
- Wikipedia. (2019). Kohlenstoff-Allotrope. Wiederhergestellt von: es.wikipedia.org
- Sederberg David. (s.f.). Allotrope von Kohlenstoff. Wiederhergestellt von: web.ics.purdue.edu
- Sederberg, D. (2009). Allotrope von Kohlenstoff: Es hängt alles davon ab, wie Sie zusammengesetzt sind. Wiederhergestellt von: physics.purdue.edu
- Hirsh A. (2010). Die Ära der Kohlenstoff-Allotrope. Institut für Chemie und Pharmazie & Interdisziplinäres Zentrum für Molekulare Materialien (ICMM), Friedrich-Alexander-Universität Erlangen-Nürnberg, Henkestrasse 42, 91054 Erlangen.
- Das Board of Regents der University of Wisconsin System. (2013). Nanoröhren und andere Formen von Kohlenstoff. Wiederhergestellt von: chemie.beloit.edu
- Clark Jim. (2012). Riesige kovalente Strukturen. Wiederhergestellt von: chemguide.co.uk



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.