
Perchlorsäureformel, Eigenschaften und Verwendung

Das Perchlorsäure Es ist eine sehr starke Mineralsäure, die normalerweise als farblose und geruchlose wässrige Lösung vorkommt und Metalle und Textilien angreift. Im heißen Zustand ist es ein starkes Oxidationsmittel, aber seine wässrigen Lösungen (bis zu etwa 70 Gew .-%) bei Raumtemperatur sind im Allgemeinen sicher und zeigen nur starke Säureeigenschaften und keine oxidierenden Eigenschaften..
Perchlorsäure und ihre Salze (insbesondere Ammoniumperchlorat [NH4ClO4, CAS: 7790-98-9], Natriumperchlorat [NaClO4, 7601-89-0] und Kaliumperchlorat [KClO4, 7778-74-7]) finden aufgrund ihrer starken Oxidationskraft viele Anwendungen.

Seine Produktion hat aufgrund seiner Verwendung als Ausgangsmaterial für die Herstellung von reinem Ammoniumperchlorat, einem Grundbestandteil von Sprengstoffen und festen Treibmitteln für Raketen und Raketen, zugenommen..

In begrenztem Umfang wird auch Perchlorsäure als Reagenz für analytische Zwecke verwendet. Die geschlossenen Behälterbehälter können bei längerer Hitzeeinwirkung heftig platzen..
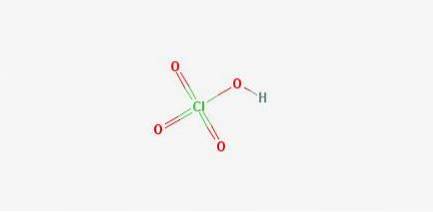
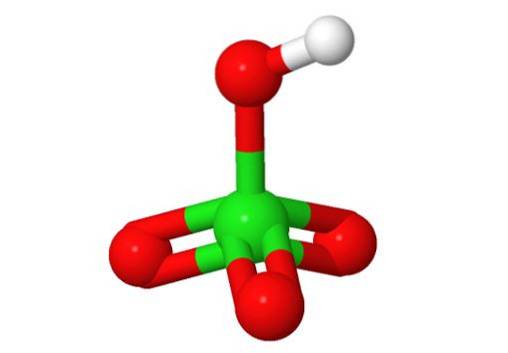
Formeln: Perchlorsäure: HClO4
CAS: 7601-90-3
2D-Struktur
3D-Struktur
Perchlorsäureeigenschaften
Physikalische und chemische Eigenschaften
- Aussehen: farblose Flüssigkeit
- Geruch: geruchlos
- Molekulargewicht: 100,454 g / mol
- Siedepunkt: 19 ° C.
- Schmelzpunkt: -112 ° C.
- Dichte: 1,768 g / cm³
- Löslichkeit in Wasser: mischbar
- Säure (pKa): -15,2 (± 2,0)
Perchlorsäure gehört zur Gruppe der stark oxidierenden Säuren.
Entzündbarkeit
-Starke oxidierende Säuren sind im Allgemeinen nicht brennbar, können jedoch die Verbrennung anderer Materialien durch Bereitstellung von Sauerstoff (der als Oxidationsmittel wirkt) beschleunigen..
-Perchlorsäurelösungen können durch Hitze oder Verunreinigungen explodieren.
-Wenn sie über 160 ° C erhitzt werden oder in ein Feuer verwickelt sind, können sie sich explosionsartig zersetzen.
-Sie können explosionsartig mit Kohlenwasserstoffen (Kraftstoffen) reagieren. Es kann Brennstoffe (Holz, Papier, Öl, Kleidung usw.) entzünden..
-Behälter können beim Erhitzen explodieren.
-Abfluss kann eine Brand- oder Explosionsgefahr verursachen.
Reaktivität
-Stark oxidierende Säuren sind im Allgemeinen unter Freisetzung von Wasserstoffionen in Wasser löslich. Die resultierenden Lösungen haben einen pH von 1 oder nahe 1.
-Materialien dieser Gruppe reagieren mit chemischen Basen (z. B. anorganischen Aminen und Hydroxiden) unter Bildung von Salzen. Diese Neutralisationsreaktionen treten auf, wenn die Base Wasserstoffionen akzeptiert, die die Säure abgibt.
-Neutralisationen können auf kleinem Raum gefährlich große Wärmemengen erzeugen.
-Die Zugabe von Wasser zu Säuren erzeugt häufig genug Wärme in dem kleinen Bereich der Mischung, um diesen Teil des Wassers explosionsartig zu kochen, was zu sehr gefährlichen Säurespritzern führen kann..
-Diese Materialien haben eine signifikante Kapazität als Oxidationsmittel, aber diese Kapazität variiert von einem zum anderen..
-Sie können mit aktiven Metallen (wie Eisen und Aluminium) und auch mit vielen weniger aktiven Metallen reagieren, um das Metall aufzulösen und Wasserstoff und / oder giftige Gase freizusetzen.
-Seine Reaktionen mit Cyanidsalzen und seinen Verbindungen setzen gasförmigen Cyanwasserstoff frei..
-Entzündbare und / oder toxische Gase entstehen auch durch ihre Reaktionen mit Dithiocarbamaten, Isocyanaten, Mercaptanen, Nitriden, Nitrilen, Sulfiden und schwachen oder starken Reduktionsmitteln..
-Zusätzliche gaserzeugende Reaktionen treten mit Sulfiten, Nitriten, Thiosulfaten (zu H2S und SO3), Dithioniten (SO2) und sogar Carbonaten auf: Das Kohlendioxidgas des letzteren ist nicht toxisch, aber die Wärme und Spritzer der Reaktion können gestört werden.
-Perchlorsäurelösungen sind stark oxidierende Säurelösungen.
-Sie können heftig reagieren oder detonieren, wenn sie mit oxidierbaren Materialien gemischt werden (unter anderem Alkohole, Amine, Borane, Dicyanogen, Hydrazine, Kohlenwasserstoffe, Wasserstoff, Nitroalkane, Metallpulver, Silane und Thiole)..
-Perchlorsäure entzündet sich bei Kontakt mit Sulfinylchlorid.
Toxizität
-Stark oxidierende Säuren wirken ätzend auf Textilien. Säuredämpfe reizen empfindliche Gewebe (wie Augen und Atemwege) stark.
-Einatmen, Verschlucken oder Kontakt (von Haut, Augen usw.) mit Perchlorsäurelösungen oder deren Dämpfen kann zu schweren Verletzungen, Verbrennungen oder zum Tod führen..
-Wenn sie mit Feuer in Kontakt kommen, können sie reizende, ätzende und / oder giftige Gase erzeugen..
-Abfluss von Brandschutz- oder Verdünnungswasser kann zu Verunreinigungen führen.
Anwendungen
-Perchlorsäure wird in den Bereichen wissenschaftliche Forschung und Entwicklung sowie bei der Herstellung von Chemikalien sowie elektrischen, elektronischen und optischen Geräten verwendet.
-Es wird als Vorstufe bei der Herstellung von reinem Ammoniumperchlorat verwendet, einem Grundbestandteil von Sprengstoffen und festen Treibmitteln für Raketen und Raketen..
-Perchlorsäure, die zu Hause verwendet wird, umfasst Toiletten-, Metall- und Abflussreiniger, Rostentferner, Batterien und eine Grundierung für falsche Nägel..
-Industrielle Anwendungen umfassen: Metallveredelung, Sanitär, Bleichen, Ätzen, Galvanisieren, Fotografieren, Desinfizieren, Munition, Düngemittelherstellung, Metallreinigung und Rostentfernung.
-In begrenztem Umfang wird auch Perchlorsäure als Reagenz für analytische Zwecke verwendet..
Klinische Wirkungen
Säuren verursachen Gerinnungsnekrosen. Wasserstoffionen trocknen Epithelzellen aus und verursachen Ödeme, Erytheme, Gewebeabgabe und Nekrose unter Bildung von Geschwüren und Dekubitus..
Bei Exposition gegenüber diesen Säuren über den Magen-Darm-Weg können Patienten Verbrennungen vom Grad II (oberflächliche Blasen, Erosionen und Ulzerationen) entwickeln, bei denen das Risiko einer nachfolgenden Strikturbildung besteht, insbesondere auf dem Magenweg und der Speiseröhre..
Es können sich auch tiefe Verbrennungen und Nekrosen der Magen-Darm-Schleimhaut entwickeln. Komplikationen sind häufig Perforation (Speiseröhre, Magen, selten Zwölffingerdarm), Fistelbildung (tracheoösophageal, aortoösophageal) und gastrointestinale Blutungen..
Inhalationsexposition kann Dyspnoe, pleuritische Brustschmerzen, Husten und Bronchospasmus, Ödeme der oberen Atemwege und Verbrennungen verursachen. Ödeme der oberen Atemwege sind häufig und oft lebensbedrohlich.
Augenexposition kann schwere Reizungen und Chemosen der Bindehaut, epitheliale Hornhautdefekte, limbische Ischämie, dauerhaften Sehverlust und in schweren Fällen von Perforation verursachen..
Eine leichte dermale Exposition kann zu Reizungen und Verbrennungen mit teilweiser Dicke führen. Eine längere oder hochkonzentrierte Exposition kann zu Verbrennungen in voller Dicke führen.
Komplikationen können Cellulitis, Sepsis, Kontrakturen, Osteomyelitis und systemische Toxizität sein.
Sicherheit und Risiken
Gefahrenhinweise des global harmonisierten Systems zur Einstufung und Kennzeichnung von Chemikalien (GHS)
Das global harmonisierte System zur Einstufung und Kennzeichnung von Chemikalien (GHS) ist ein international vereinbartes System, das von den Vereinten Nationen geschaffen wurde und die verschiedenen in verschiedenen Ländern verwendeten Klassifizierungs- und Kennzeichnungsstandards durch weltweit einheitliche Kriterien ersetzen soll..
Die Gefahrenklassen (und das entsprechende GHS-Kapitel), Klassifizierungs- und Kennzeichnungsstandards sowie Empfehlungen für Perchlorsäure lauten wie folgt (Europäische Chemikalienagentur, 2017; Vereinte Nationen, 2015; PubChem, 2017):
GHS-Gefahrenhinweise
H271: Kann Feuer oder Explosion verursachen; Starkes Oxidationsmittel [Gefahr Oxidierende Flüssigkeiten; Oxidierende Feststoffe - Kategorie 1] (PubChem, 2017).
H290: Kann für Metalle ätzend sein [Warnung Ätzend für Metalle - Kategorie 1] (PubChem, 2017).
H302: Schädlich beim Verschlucken [Warnung Akute Toxizität, oral - Kategorie 4] (PubChem, 2017).
H314: Verursacht schwere Hautverbrennungen und Augenschäden [Gefahr Hautkorrosion / -reizung - Kategorie 1A, B, C] (PubChem, 2017).
H318: Verursacht schwere Augenschäden [Gefahr Schwerer Augenschaden / Augenreizung - Kategorie 1] (PubChem, 2017).
H371: Kann Organschäden verursachen [Warnung Spezifische Zielorgan-Toxizität, einmalige Exposition - Kategorie 2] (PubChem, 2017).
Warnhinweise
P210, P220, P221, P234, P260, P264, P270, P280, P283, P301 + P312, P301 + P330 + P331, P303 + P361 + P353, P304 + P340, P305 + P351 + P338, P306 + P360, P309 + P311, P310, P321, P330, P363, P370 + P378, P371 + P380 + P375, P390, P404, P405 und P501 (PubChem, 2017).





Verweise
- Europäische Chemikalienagentur (ECHA). (2016). Perchlorsäure. Kurzprofil. Abgerufen am 8. Februar 2017 von: echa.europa.eu.
- JSmol (2017) Perchlorsäure. [Bild] Wiederhergestellt von: chemapps.stolaf.edu.
- NASA (2008) Ares-1-Start 02-2008 [Bild] Wiederhergestellt von: commons.wikimedia.org.
- Nationales Zentrum für Informationen zur Biotechnologie. PubChem Compound Database. (2017). Perchlorsäure - PubChem-Struktur. [Bild] Bethesda, MD, EU: National Library of Medicine. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.
- Oelen, W. (2011) Perchlorsäure 60 Prozent [Bild] Wiederhergestellt von: en.wikipedia.org.
- Wikipedia. (2017). Perchlorsäure. Abgerufen am 8. Februar 2017 von: es.wikipedia.org.
- Wikipedia. (2017). Perchlorsäure. Abgerufen am 8. Februar 2017 von: es.wikipedia.org.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.