
Antimongeschichte, Struktur, Eigenschaften, Verwendungen und Risiken
Das Antimon Es ist ein glänzendes, silbernes Metalloid mit einem gewissen bläulichen Farbton. Sein Feststoff zeichnet sich auch dadurch aus, dass er eine sehr spröde und schuppige Textur aufweist. Es gehört zur Gruppe 15 des Periodensystems, angeführt von Stickstoff. Nach Wismut (und Moscovium) ist es das schwerste Element der Gruppe.
Es wird durch das chemische Symbol Sb dargestellt. In der Natur kommt es hauptsächlich in Stibit- und Ullmannit-Mineralerzen vor, deren chemische Formeln Sb sindzweiS.3 bzw. NiSbS. Seine hohe Neigung zur Bildung von Sulfiden anstelle von Oxiden beruht auf seiner chemisch weichen.

Andererseits ist Antimon auch physikalisch weich und weist auf der Mohs-Skala eine Härte von 3 auf. Es ist bei Raumtemperatur stabil und reagiert nicht mit Luftsauerstoff. Wenn es jedoch in Gegenwart von Sauerstoff erhitzt wird, bildet es Antimontrioxid, SbzweiODER3.
Ebenso ist es resistent gegen die Einwirkung schwacher Säuren; aber wenn es heiß ist, wird es von Salpetersäure und Salzsäure angegriffen.
Antimon hat zahlreiche Anwendungen, unter anderem wird es in Legierungen mit Blei und Zinn, bei der Herstellung von Fahrzeugbatterien, reibungsarmen Materialien usw. verwendet..
Dieses Metalloid hat die seltene Eigenschaft, beim Erstarren an Volumen zuzunehmen, so dass seine Legierungen den Raum, der zum Formen des herzustellenden Instruments verwendet wird, vollständig einnehmen können..
Artikelverzeichnis
- 1 Geschichte seiner Entdeckung
- 1.1 Vor Christus
- 1.2 Einführung des Begriffs
- 1.3 Erhalten
- 2 Struktur von Antimon
- 2.1 Allotropie
- 3 Eigenschaften
- 3.1 Atomgewicht
- 3.2 Ordnungszahl
- 3.3 Elektronische Konfiguration
- 3.4 Oxidationsstufen
- 3.5 Physikalische Beschreibung
- 3.6 Schmelzpunkt
- 3.7 Siedepunkt
- 3.8 Dichte
- 3.9 Schmelzwärme
- 3.10 Verdampfungswärme
- 3.11 Molare Wärmekapazität
- 3.12 Elektronegativität
- 3.13 Atomradius
- 3.14 Härte
- 3.15 Stabilität
- 3.16 Isotope
- 3.17 Elektrische und thermische Leitfähigkeit
- 3.18 Chemische Reaktivität
- 4 Verwendungen
- 4.1 Legierungen
- 4.2 Feuerhemmend
- 4.3 Elektronikfeld
- 4.4 Medizin und Veterinärmedizin
- 4.5 Pigmente und Farben
- 4.6 Andere Verwendungen
- 5 Risiken
- 6 Referenzen
Geschichte seiner Entdeckung
BC
Es gibt Hinweise darauf, dass Antimonsulfid seit 3100 v. Chr. In Ägypten als Kosmetik verwendet wurde. In Mesopotamien, dem heutigen Irak, wurden Überreste einer Vase und eines weiteren Artefakts gefunden, das vermutlich zwischen 3000 und 2200 v. Chr. Datiert und bei dessen Herstellung Antimon verwendet wurde.
Einführung des Begriffs
Der römische Gelehrte Plinius der Ältere (23-79 n. Chr.) Beschrieb in seiner Abhandlung über die Naturgeschichte die Verwendung von Antimon, das er Stibius nannte, bei der Ausarbeitung von sieben Arzneimitteln. Dem Alchemisten Abu Mussa Jahir Ibn Hayyan (721-815) wird die Einführung des Begriffs Antimon zur Bezeichnung des Elements zugeschrieben.
Er verwendete die folgende Etymologie: "anti" als Synonym für Negation und "mono" nur für. Dann wollte er betonen, dass Antimon nicht nur in der Natur vorkommt. Es ist bereits bekannt, dass es Teil von Sulfidmineralien sowie vielen anderen Elementen ist.
Erhalten
Es wird angenommen, dass der griechische Naturist Pedanius Diascorides reines Antimon erhalten hat, indem er Antimonsulfid in einem Luftstrom erhitzt hat. Der italienische Metallurge Vannocio Biringucio beschreibt in dem Buch De la Pirotecnia (1540) eine Methode zur Isolierung von Antimon.
Der deutsche Chemiker Andreas Libavius (1615) erzielte unter Verwendung einer geschmolzenen Mischung aus Eisen, Antimonsulfid, Salz und Kaliumtartrat die Herstellung eines kristallinen Antimons.
Der erste ausführliche Bericht über Antimon wurde 1707 vom französischen Chemiker Nicolas Lemery (1645-1715) in seinem Buch Abhandlung über Antimon erstellt.
Antimonstruktur
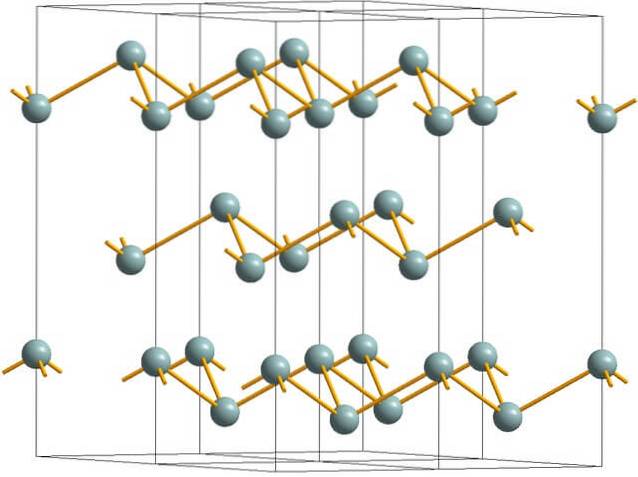
Das obere Bild zeigt die faltige Schichtstruktur der Arsenatome. Graues Antimon, besser bekannt als metallisches Antimon, nimmt jedoch auch diese Struktur an. Es wird gesagt, dass es "faltig" ist, weil es Sb-Atome gibt, die aus der aus der Schicht zusammengesetzten Ebene auf- und absteigen.
Obwohl diese Schichten für die Photonen verantwortlich sind, die mit ihnen interagieren, leuchten sie silbrig und lassen Antimon als Metall durchgehen. Die Wahrheit ist jedoch, dass die Kräfte, die sie vereinen, schwach sind. daher können die scheinbaren Metallfragmente von Sb leicht gemahlen und spröde oder schuppig sein.
Außerdem sind die Sb-Atome in den faltigen Schichten nicht nahe genug, um ihre Atomorbitale zu gruppieren, um ein Band zu erzeugen, das eine elektrische Leitung ermöglicht..
Wenn man eine graue Kugel einzeln betrachtet, kann man sehen, dass sie drei Sb-Sb-Bindungen aufweist. Von einer höheren Ebene aus konnte Sb in der Mitte eines Dreiecks gesehen werden, wobei sich drei Sb an seinen Eckpunkten befanden. Das Dreieck ist jedoch nicht flach und hat zwei Ebenen oder Stockwerke..
Die laterale Reproduktion solcher Dreiecke und ihrer Bindungen bildet faltige Schichten, die sich zu rhomboedrischen Kristallen ausrichten..
Allotropie
Die soeben beschriebene Struktur entspricht grauem Antimon, dem stabilsten seiner vier Allotrope. Die anderen drei Allotrope (schwarz, gelb und explosiv) sind metastabil; Das heißt, sie können unter sehr rauen Bedingungen existieren.
Es gibt nicht viele Informationen über ihre Strukturen. Es ist jedoch bekannt, dass schwarzes Antimon amorph ist, so dass seine Struktur chaotisch und kompliziert ist..
Gelbes Antimon ist unter -90ºC stabil, verhält sich wie ein nichtmetallisches Element und kann vermutet werden, dass es aus kleinen Agglomeraten vom Sb-Typ besteht4 (ähnlich denen von Phosphor); beim Erhitzen wandelt es sich in das schwarze Allotrop um.
Und in Bezug auf explosives Antimon besteht es aus einer gelatineartigen Ablagerung, die sich während der Elektrolyse einer wässrigen Lösung eines Antimonhalogenids auf der Kathode gebildet hat..
Bei der geringsten starken Reibung oder dem geringsten Aufprall gibt der weiche Feststoff so viel Wärme ab, dass er explodiert und sich stabilisiert, wenn sich seine Atome in der rhomboedrischen Kristallstruktur von grauem Antimon neu gruppieren..
Eigenschaften
Atomares Gewicht
121,76 g / mol.
Ordnungszahl
51.
Elektronische Konfiguration
[Kr] 4d105szwei5 p3.
Oxidationszustände
-3, -2, -1, +1, +2, +3, +4, +5.
Physische Beschreibung
Glänzendes Silber fest, spröde, mit einer schuppigen Oberfläche, mit einem bläulichen Farbton. Es kann auch als Schwarzpulver erscheinen.
Schmelzpunkt
630,63 ºC.
Siedepunkt
1.635 ºC.
Dichte
-6,697 g / cm3 bei Raumtemperatur.
-6,53 g / cm3 im flüssigen Zustand Temperatur gleich oder größer als der Schmelzpunkt.
Schmelzwärme
19,79 kJ / mol.
Verdampfungswärme
193,43 kJ / mol.
Molare Wärmekapazität
25,23 J / mol.K.
Elektronegativität
2,05 (Pauling-Skala).
Atomradio
140 Uhr.
Härte
Es ist ein weiches Element mit einer Härte von 3 auf der Mohs-Skala und kann durch Glas zerkratzt werden.
Stabilität
Es ist bei Raumtemperatur stabil und erfährt keine Oxidation. Es ist auch resistent gegen Säureangriff.
Isotope
Es hat zwei stabile Isotope: 121Sb und 123Sb. Zusätzlich gibt es 35 radioaktive Isotope. Das radioaktive Isotop 125Sb ist derjenige mit der längsten Halbwertszeit: 2,75 Jahre. Im Allgemeinen emittieren radioaktive Isotope β-Strahlung+ und β-.
Elektrische und thermische Leitfähigkeit
Antimon ist ein schlechter Wärme- und Stromleiter.
Chemische Reaktivität
Es kann Wasserstoff nicht aus verdünnten Säuren verdrängen. Bildet mit organischen und anorganischen Säuren ionische Komplexe. Metallisches Antimon reagiert nicht mit Luft, sondern wird in feuchter Luft schnell in Oxid umgewandelt..
Halogene und Sulfide oxidieren Antimon leicht, wenn der Prozess bei erhöhten Temperaturen abläuft.
Anwendungen
Legierungen
Antimon wird in einer Legierung mit Blei verwendet, um Platten für Autobatterien herzustellen, wodurch der Widerstand der Platten sowie die Eigenschaften der Ladungen verbessert werden..
Die Legierung mit Blei und Zinn wurde verwendet, um die Eigenschaften von Schweißnähten sowie die von Markierungskugeln und Patronenzündern zu verbessern. Es wird auch in Legierungen zum Beschichten von elektrischen Kabeln verwendet..
Antimon wird in Antifriktionslegierungen, bei der Herstellung von Zinn- und Härtungslegierungen mit geringem Zinngehalt bei der Herstellung von Orgeln und anderen Musikinstrumenten verwendet..
Es hat die mit Wasser geteilte Eigenschaft, dass es an Volumen zunimmt, wenn es kondensiert; Daher füllt das in den Legierungen vorhandene Antimon mit Blei und Zinn alle Räume in den Formen aus und verbessert die Definition der mit diesen Legierungen hergestellten Strukturen..
Feuerdämmend
Antimontrioxid wird zur Herstellung feuerhemmender Verbindungen verwendet, immer in Kombination mit halogenierten feuerhemmenden Mitteln, Bromiden und Chloriden..
Feuerhemmer können mit Sauerstoffatomen und OH-Radikalen reagieren, was das Feuer hemmt. Diese Flammschutzmittel werden in Kinderkleidung, Spielzeug, Flugzeugen und in Autositzen verwendet.
Sie werden auch in Polyesterharzen und in Glasfaserverbundwerkstoffen für Artikel hinzugefügt, die als Abdeckungen für Leichtflugzeugtriebwerke verwendet werden..
Antimonverbindungen, die als Flammschutzmittel verwendet werden, umfassen: Antimonoxychlorid, SbOCl; Antimonpentoxid, SbO5;; Antimontrichlorid, SbCl3;; und Antimontrioxid, SbO3.
Elektronikbereich
Es wird bei der Herstellung von Halbleitern, Dioden, Detektoren im mittleren Infrarot und bei der Herstellung von Transitoren verwendet. Hochreines Antimon, das in der Halbleitertechnologie verwendet wird, wird durch Reduktion von Antimonverbindungen mit Wasserstoff erhalten.
Medizin und Veterinärmedizin
Antimonverbindungen werden in der Medizin seit der Antike als Emetika und Antiprotozoen eingesetzt. Kalium-Kalium-Tartrat (Zahnstein-Brechmittel) wurde lange Zeit als Antischistosom verwendet; wird zusätzlich als Expektorans, Diaphoretikum und Brechmittel verwendet.
Antimonsalze wurden auch zur Konditionierung der Haut von Wiederkäuern verwendet; wie Aniomalin und Lithiumantimonthiomalat.
Meglumin-Antimoniat ist ein Medikament zur Behandlung von Leishmaniose in äußeren Herden von Haustieren. Der therapeutische Nutzen war jedoch begrenzt.
Pigmente und Farben
Antimonverbindungen werden bei der Herstellung von Farben und Trübungsmitteln in Emails verwendet. Sie werden auch in Zinnoberrot-, Gelb- und Orangenpigmenten verwendet, die Produkte der langsamen Oxidation von Antimonsulfiden sind..
Einige seiner organischen Salze (Tartrate) werden in der Textilindustrie verwendet, um die Bindung bestimmter Farbstoffe zu unterstützen.
Antimonsulfid wurde im alten Ägypten als Kosmetik zur Verdunkelung der Augen verwendet.
Andere Verwendungen
Einige Antimonsalze werden als Beschichtungsmittel verwendet, um mikroskopisch kleine Blasen zu entfernen, die sich auf Fernsehbildschirmen bilden. Antimonionen interagieren mit Sauerstoff und eliminieren dessen Neigung zur Blasenbildung.
Antimon (III) sulfid wird in den Köpfen einiger Sicherheitsstreichhölzer verwendet. Antimonsulfid wird auch verwendet, um den Reibungskoeffizienten von Materialien zu stabilisieren, die in Kfz-Bremsbelägen verwendet werden..
Isotop 124Sb wird zusammen mit Beryllium als Neutronenquelle mit einem Energiedurchschnitt von 24 keV verwendet. Darüber hinaus wird Antimon als Katalysator bei der Herstellung von Kunststoffen verwendet..
Risiken
Es ist ein sprödes Element, so dass bei seiner Handhabung umweltschädlicher Staub aus der Umwelt entstehen kann. Bei Arbeitern, die Antimonstaub ausgesetzt waren, wurden Dermatitis, Renitis, Entzündungen der oberen Atemwege und Bindehautentzündungen beobachtet.
Pneumokoniose, manchmal kombiniert mit obstruktiven Lungenveränderungen, wurde nach längerer Exposition beschrieben.
Antimontrioxid kann die Herzfunktion lebensbedrohlich schädigen.
Bei Personen, die diesem Element ausgesetzt sind, wurde das Vorhandensein vorübergehender Pustelhautinfektionen beobachtet..
Die kontinuierliche Einnahme niedriger Dosen dieses Metalls kann Durchfall, Erbrechen und Magengeschwüre verursachen. Ebenso beträgt die maximal tolerierbare Konzentration in Luft 0,5 mg / m3.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Manny. (11. März 2009). Gelbes Antimon und explosives Antimon. Wiederhergestellt von: antimonyproperties.blogspot.com
- Prof. Ernst Cohen und J.C. Van Den Bosch. (1914). Die Allotropie des Antimons. Verfahren Royal Acad. Amsterdam. Vol. XVII.
- Wikipedia. (2019). Antimon. Wiederhergestellt von: en.wikipedia.org
- Advameg, Inc. (2019). Antimon. Wiederhergestellt von: Chemistryexplained.com
- Sable Mc'Oneal. (15. September 2018). Chemie: Eigenschaften und Anwendung von Sb-Antimon. Wiederhergestellt von: medium.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.