
Eigenschaften, Verwendungen und Beispiele für organische Salze

Das organische Salze Sie sind eine dichte Anzahl ionischer Verbindungen mit unzähligen Eigenschaften. Sie wurden zuvor von einer organischen Verbindung abgeleitet, die eine Umwandlung erfahren hat, die es ihr ermöglicht, eine Ladung zu tragen, und auch ihre chemische Identität hängt vom assoziierten Ion ab.
Im Bild unten sind zwei sehr allgemeine chemische Formeln für organische Salze dargestellt. Die erste, R-AX, wird als Verbindung interpretiert, in deren Kohlenstoffstruktur ein Atom oder eine Gruppe A eine positive + oder negative Ladung trägt (-).
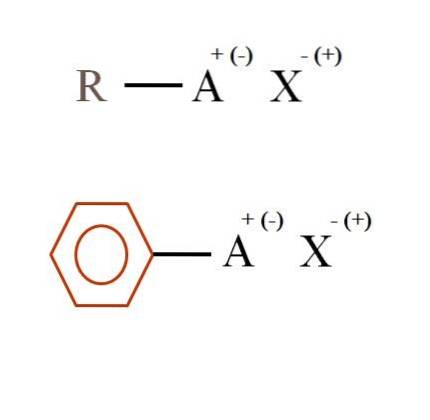
Wie zu sehen ist, besteht eine kovalente Bindung zwischen R und A, RA, aber A hat wiederum eine formale Ladung, die das Ion X anzieht (oder abstößt). Das Vorzeichen der Ladung hängt von der Art von A und dem ab chemische Umgebung.
Wenn A positiv wäre, mit wie vielen X könnte es interagieren? Mit nur einem nach dem Prinzip der Elektroneutralität (+ 1-1 = 0). Was ist jedoch die Identität von X? Anion X könnte CO sein3zwei-, erfordert zwei RA-Kationen+;; ein Halogenid: F.-, Cl-, Br-, usw.; oder sogar eine andere RA-Verbindung-. Die Optionen sind nicht kalkulierbar.
Ein organisches Salz kann auch aromatischen Charakter haben, wie der braune Benzolring zeigt. Das Benzoatsalz von Kupfer (II), (C.6H.5GURREN)zweiCu besteht beispielsweise aus zwei aromatischen Ringen mit negativ geladenen Carboxylgruppen, die mit dem Cu-Kation interagieren.zwei+.
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften
- 1.1 Hochmolekulare Massen
- 1.2 Amphiphile und Tenside
- 1.3 Hohe Siede- oder Schmelzpunkte
- 1.4 Säure und Basizität
- 2 Verwendungen
- 3 Beispiele für organische Salze
- 3.1 Carboxylate
- 3.2 Lithiumdiakylcuprate
- 3.3 Sulfoniumsalze
- 3.4 Oxoniumsalze
- 3.5 Aminsalze
- 3.6 Diazoniumsalze
- 4 Referenzen
Physikalische und chemische Eigenschaften
Aus dem Bild kann man sagen, dass organische Salze aus drei Komponenten bestehen: dem organischen, R oder Ar (dem aromatischen Ring), einem Atom oder einer Gruppe, die die Ionenladung A trägt, und einem Gegenion X..
So wie die Identität und die chemische Struktur durch solche Komponenten definiert werden, hängen auch ihre Eigenschaften von ihnen ab..
Aus dieser Tatsache lassen sich bestimmte allgemeine Eigenschaften zusammenfassen, die die überwiegende Mehrheit dieser Salze erfüllt..
Hochmolekulare Massen
Unter der Annahme ein- oder mehrwertiger anorganischer X-Anionen neigen organische Salze dazu, viel größere Molekularmassen zu haben als anorganische Salze. Dies ist hauptsächlich auf das Kohlenstoffgerüst zurückzuführen, dessen einzelne C-C-Bindungen und ihre Wasserstoffatome viel Masse zur Verbindung beitragen..
Daher sind R oder Ar für ihre hohen Molekularmassen verantwortlich..
Amphiphile und Tenside
Organische Salze sind amphiphile Verbindungen, dh ihre Strukturen haben sowohl hydrophile als auch hydrophobe Enden..
Was sind solche Extreme? R oder Ar stellen die extreme Hydrophobie dar, da ihre C- und H-Atome keine große Affinität zu Wassermolekülen aufweisen.
ZU+(-), Das ladungstragende Atom oder die Gruppe ist das hydrophile Ende, da es zum Dipolmoment beiträgt und mit Wasser unter Bildung von Dipolen (RA) wechselwirkt+ Ohzwei).
Wenn die hydrophilen und hydrophoben Bereiche polarisiert sind, wird das amphiphile Salz zu einem Tensid, einer Substanz, die häufig zur Herstellung von Detergenzien und verwendet wird Demulgatoren.
Hohe Siede- oder Schmelzpunkte
Wie anorganische Salze weisen auch organische Salze aufgrund der elektrostatischen Kräfte, die die flüssige oder feste Phase bestimmen, hohe Schmelz- und Siedepunkte auf..
Da es jedoch eine organische Komponente R oder Ar gibt, sind andere Arten von Van-der-Waals-Kräften beteiligt (Londoner Kräfte, Dipol-Dipol-, Wasserstoffbrückenbindungen), die in gewisser Weise mit der Elektrostatik konkurrieren..
Aus diesem Grund sind die festen oder flüssigen Strukturen organischer Salze in erster Linie komplexer und vielfältiger. Einige von ihnen können sich sogar so verhalten Flüssigkristalle.
Säure und Basizität
Organische Salze sind im Allgemeinen stärkere Säuren oder Basen als anorganische Salze. Dies liegt daran, dass A, beispielsweise in Aminsalzen, aufgrund seiner Bindung mit einem zusätzlichen Wasserstoff eine positive Ladung aufweist: A.+-H. Spenden Sie dann in Kontakt mit einer Base das Proton, um wieder eine neutrale Verbindung zu werden:
RA+H + B => RA + HB
Das H gehört zu A, wird aber geschrieben, da es an der Neutralisationsreaktion teilnimmt.
Auf der anderen Seite RA+ Es kann ein großes Molekül sein, das mit dem Hydroxyl- oder Hydroxylanion OH keine Feststoffe mit einem ausreichend stabilen Kristallgitter bilden kann-.
Wenn dies so ist, das RA-Salz+Oh- verhält sich wie eine starke Basis; sogar so basisch wie NaOH oder KOH:
RA+Oh- + HCl => RACl + H.zweiODER
Beachten Sie in der chemischen Gleichung, dass das Anion Cl- ersetzt OH-, Bildung des Salzes RA+Cl-.
Anwendungen
Die Verwendung von organischen Salzen variiert je nach Identität von R, Ar, A und X. Darüber hinaus hängt ihre Anwendung auch von der Art des Feststoffs oder der Flüssigkeit ab, die sie bilden. Einige diesbezügliche Allgemeingültigkeiten sind:
-Sie dienen als Reagenzien für die Synthese anderer organischer Verbindungen. RAX kann als "Donor" für die R-Kette fungieren, um zu einer anderen Verbindung hinzuzufügen, die eine gute Abgangsgruppe ersetzt.
-Sie sind Tenside und können daher auch als Schmiermittel verwendet werden. Zu diesem Zweck werden Metallsalze von Carboxylaten verwendet.
-Sie ermöglichen die Synthese einer Vielzahl von Farbstoffen.
Beispiele für organische Salze
Carboxylate
Carbonsäuren reagieren mit einem Hydroxid in einer Neutralisationsreaktion unter Bildung von Carboxylatsalzen: RCOO- M.+;; wo M.+ kann ein beliebiges Metallkation sein (Na+, Pbzwei+, K.+, etc.) oder das Ammoniumkation NH4+.
Fettsäuren sind Carbonsäuren mit langer aliphatischer Kette, sie können gesättigt und ungesättigt sein. Unter den gesättigten sind Palmitinsäure (CH3(CHzwei)14COOH). Hieraus entsteht das Palmitatsalz, während Stearinsäure (CH3(CHzwei)16COOH bildet das Stearatsalz. Aus diesen Salzen bestehen Seifen.
Für den Fall von Benzoesäure ist C.6H.5COOH (wobei C.6H.5- ist ein Benzolring), wenn er mit einer Base reagiert, bildet er Benzoatsalze. In allen Carboxylaten ist die Gruppe -COO- repräsentiert A (RAX).
Lithiumdiakylcuprate
Lithiumdiakylcuprat ist bei der organischen Synthese nützlich. Seine Formel lautet [R-Cu-R]-Li+, in dem das Kupferatom eine negative Ladung trägt. Hier repräsentiert das Kupfer Atom A im Bild.
Sulfoniumsalze
Sie entstehen aus der Reaktion eines organischen Sulfids mit einem Alkylhalogenid:
R.zweiS + R'X => R.zweiR'S+X.
Für diese Salze trägt das Schwefelatom eine positive formale Ladung (S.+) durch drei kovalente Bindungen.
Oxoniumsalze
Ebenso reagieren Ether (die sauerstoffhaltigen Analoga von Sulfiden) mit Hydraciden unter Bildung von Oxoniumsalzen:
ROR '+ HBr <=> RO+HR '+ Br-
Das saure Proton von HBr ist kovalent an das Sauerstoffatom des Ethers gebunden (R.zweiODER+-H), positiv aufladen.
Aminsalze
Amine können wie ihre Salze primär, sekundär, tertiär oder quaternär sein. Alle von ihnen zeichnen sich dadurch aus, dass ein H-Atom an das Stickstoffatom gebunden ist.
Somit ist RNH3+X.- ist ein primäres Aminsalz; R.zweiNHzwei+X.-, sekundäres Amin; R.3NH+X.-, tertiäres Amin; und R.4N.+X.-, quaternäres Amin (quaternäres Ammoniumsalz).
Diazoniumsalze
Schließlich werden Diazoniumsalze (RNzwei+X.-) oder Aryldiazonium (ArNzwei+X.-) stellen den Ausgangspunkt vieler organischer Verbindungen dar, insbesondere von Azofarbstoffen.
Verweise
- Francis A. Carey. Organische Chemie. (Sechste Ausgabe, Seiten 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T. W., Craig B. Fryhle. Organische Chemie. Amine. (10. Auflage). Wiley plus.
- Wikipedia. (2018). Salz (Chemie). Entnommen aus: en.wikipedia.org
- Steven A. Hardinger. (2017). Illustriertes Glossar der Organischen Chemie: Salze. Wiederhergestellt von: chem.ucla.edu
- Chevron Oronite. (2011). Carboxylate. [PDF]. Wiederhergestellt von: oronite.com
Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.