
Primäre Kohlenstoffmerkmale, -typen und -beispiele
Das Primärkohlenstoff Es ist eines, das in jeder Verbindung unabhängig von ihrer molekularen Umgebung eine Bindung mit mindestens einem anderen Kohlenstoffatom eingeht. Diese Bindung kann einfach, doppelt (=) oder dreifach (≡) sein, solange nur zwei Kohlenstoffatome verbunden sind und sich in benachbarten Positionen befinden (logisch).
Die auf diesem Kohlenstoff vorhandenen Wasserstoffatome werden als primäre Wasserstoffatome bezeichnet. Die chemischen Eigenschaften des primären, sekundären und tertiären Wasserstoffs unterscheiden sich jedoch kaum und unterliegen überwiegend den molekularen Umgebungen von Kohlenstoff. Aus diesem Grund wird primärer Kohlenstoff (1 °) üblicherweise wichtiger behandelt als seine Wasserstoffatome.
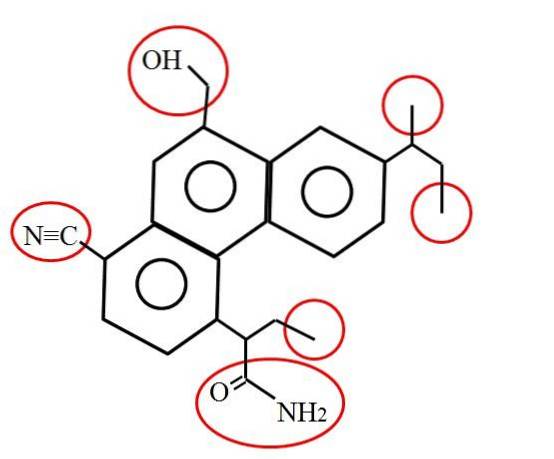
Und wie sieht ein Primärkohlenstoff aus? Die Antwort hängt, wie erwähnt, von Ihrer molekularen oder chemischen Umgebung ab. Das obige Bild zeigt beispielsweise die in roten Kreisen eingeschlossenen Primärkohlenstoffe in der Struktur eines hypothetischen (wenn auch wahrscheinlich realen) Moleküls..
Wenn Sie genau hinschauen, werden Sie feststellen, dass drei davon identisch sind. während die anderen drei völlig unterschiedlich sind. Die ersten drei bestehen aus Methylgruppen, -CH3 (rechts vom Molekül) und die anderen sind die Methylolgruppen -CHzweiOH, Nitril, -CN und ein Amid, RCONHzwei (links vom Molekül und darunter).
Artikelverzeichnis
- 1 Eigenschaften von Primärkohlenstoff
- 1.1 Ort und Links
- 1.2 Geringe sterische Behinderung
- 1.3 Reaktivität
- 2 Arten
- 3 Beispiele
- 3.1 Aldehyde und Carbonsäuren
- 3.2 In linearen Aminen
- 3.3 In Alkylhalogeniden
- 4 Referenzen
Eigenschaften von Primärkohlenstoff
Lage und Links
Oben wurden sechs Primärkohlenstoffe gezeigt, ohne einen anderen Kommentar als ihre Position und welche anderen Atome oder Gruppen sie begleiten. Sie können sich überall in der Struktur befinden und markieren, wo immer sie sich befinden, das "Ende der Straße". das heißt, wo ein Abschnitt des Skeletts endet. Aus diesem Grund werden sie manchmal als terminale Kohlenstoffe bezeichnet..
Somit ist es offensichtlich, dass die Gruppen -CH3 Sie sind endständig und ihr Kohlenstoff beträgt 1 °. Beachten Sie, dass dieser Kohlenstoff an drei Wasserstoffatome (die im Bild weggelassen wurden) und an einen einzelnen Kohlenstoff bindet und ihre jeweiligen vier Bindungen vervollständigt..
Daher zeichnen sie sich alle durch eine C-C-Bindung aus, die auch doppelt sein kann (C = CH)zwei) oder dreifach (C≡CH). Dies gilt auch dann, wenn andere Atome oder Gruppen an diese Kohlenstoffe gebunden sind; wie bei den anderen drei verbleibenden 1 ° -Kohlenstoffen im Bild.
Geringe sterische Behinderung
Es wurde erwähnt, dass die primären Kohlenstoffe terminal sind. Indem sie das Ende einer Strecke des Skeletts signalisieren, stören keine anderen Atome sie räumlich. Zum Beispiel die Gruppen -CH3 sie können mit Atomen anderer Moleküle interagieren; Ihre Wechselwirkungen mit benachbarten Atomen desselben Moleküls sind jedoch gering. Gleiches gilt für den -CHzweiOH und -CN.
Dies liegt daran, dass sie praktisch "Vakuum" ausgesetzt sind. Daher weisen sie im Vergleich zu den anderen Kohlenstoffarten (2., 3. und 4.) im Allgemeinen eine geringe sterische Hinderung auf..
Es gibt jedoch Ausnahmen, das Produkt einer Molekülstruktur mit zu vielen Substituenten, hoher Flexibilität oder der Tendenz, sich selbst zu schließen..
Reaktivität
Eine der Folgen der geringeren sterischen Hinderung um den 1. Kohlenstoff ist eine stärkere Exposition gegenüber Reaktionen mit anderen Molekülen. Je weniger Atome den Weg des angreifenden Moleküls zu ihm hin versperren, desto wahrscheinlicher ist seine Reaktion..
Dies gilt jedoch nur unter sterischen Gesichtspunkten. Eigentlich ist der wichtigste Faktor der elektronische; das heißt, wie ist die Umgebung der Kohlenstoffe 1 °.
Der dem primären benachbarte Kohlenstoff überträgt einen Teil seiner elektronischen Dichte auf ihn; und das gleiche kann in die entgegengesetzte Richtung geschehen, was eine bestimmte Art von chemischer Reaktion begünstigt.
Somit erklären die sterischen und elektronischen Faktoren, warum es normalerweise am reaktivsten ist; Es gibt jedoch nicht wirklich eine globale Reaktivitätsregel für alle Primärkohlenstoffe.
Typen
Primäre Kohlenstoffe haben keine intrinsische Klassifizierung. Stattdessen werden sie anhand der Atomgruppen klassifiziert, zu denen sie gehören oder an die sie gebunden sind. Dies sind die funktionellen Gruppen. Und da jede funktionelle Gruppe einen bestimmten Typ einer organischen Verbindung definiert, gibt es unterschiedliche Primärkohlenstoffe.
Zum Beispiel die Gruppe -CHzweiOH wird vom primären Alkohol RCH abgeleitetzweiOH. Primäre Alkohole bestehen daher aus 1 ° -Kohlenstoffen, die an die Hydroxylgruppe -OH gebunden sind.
Die Nitrilgruppe -CN oder -C≡N kann dagegen nur über die einzelne C-CN-Bindung direkt an ein Kohlenstoffatom gebunden werden. Somit ist die Existenz von sekundären Nitrilen (R.zweiCN) oder viel weniger tertiär (R.3CN).
Ein ähnlicher Fall tritt bei dem vom Amid -CONH abgeleiteten Substituenten aufzwei. Es kann Substitutionen der Wasserstoffatome des Stickstoffatoms eingehen; Sein Kohlenstoff kann jedoch nur an einen anderen Kohlenstoff binden und wird daher immer als primäres C-CONH betrachtetzwei.
Und in Bezug auf die -CH-Gruppe3, Es ist ein Alkylersatz, der nur an einen anderen Kohlenstoff binden kann und daher primär ist. Wenn die Ethylgruppe berücksichtigt wird, -CHzweiCH3, es wird sofort bemerkt, dass der CHzwei, Die Methylengruppe ist ein 2 ° -Kohlenstoff, da sie an zwei Kohlenstoffe (C-CH) gebunden istzweiCH3).
Beispiele
Aldehyde und Carbonsäuren
Einige Beispiele für Primärkohlenstoffe wurden erwähnt. Zusätzlich zu ihnen gibt es das folgende Gruppenpaar: -CHO und -COOH, Formyl bzw. Carboxyl genannt. Die Kohlenstoffe dieser beiden Gruppen sind primär, da sie immer Verbindungen mit den Formeln RCHO (Aldehyde) und RCOOH (Carbonsäuren) bilden..
Dieses Paar ist aufgrund der Oxidationsreaktionen, die die Formylgruppe eingeht, um sich in Carboxyl umzuwandeln, eng miteinander verwandt:
RCHO => RCOOH
Reaktion von Aldehyden oder der -CHO-Gruppe, wenn es sich um einen Substituenten in einem Molekül handelt.
In linearen Aminen
Die Klassifizierung von Aminen hängt ausschließlich vom Substitutionsgrad der Wasserstoffatome der -NH-Gruppe abzwei. Bei linearen Aminen können jedoch Primärkohlenstoffe wie bei Propanamin beobachtet werden:
CH3-CHzwei-CHzwei-NHzwei
Beachten Sie, dass der CH3 Es wird immer ein 1. Kohlenstoff sein, aber diesmal der CHzwei rechts ist auch 1 °, da es an einen einzelnen Kohlenstoff und die NH-Gruppe gebunden istzwei.
In Alkylhalogeniden
Ein Beispiel, das dem vorherigen sehr ähnlich ist, wird mit den Alkylhalogeniden (und in vielen anderen organischen Verbindungen) angegeben. Angenommen, Brompropan:
CH3-CHzwei-CHzwei-Br
Darin bleiben die primären Kohlenstoffe gleich.
Zusammenfassend lässt sich sagen, dass die 1 ° -Kohlenstoffe die Art der organischen Verbindung (und sogar der metallorganischen Verbindung) überschreiten, da sie in jedem von ihnen vorhanden sein können und einfach identifiziert werden, weil sie an einen einzelnen Kohlenstoff gebunden sind.
Verweise
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10th Auflage.). Wiley plus.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Morrison, R. T. und Boyd, R. N. (1987). Organische Chemie. (5ta Auflage). Editorial Addison-Wesley Interamericana.
- Ashenhurst J. (16. Juni 2010). Primar-, Sekundar-, Tertiär-, Quartär in der organischen Chemie. Master Organische Chemie. Wiederhergestellt von: masterorganicchemistry.com
- Wikipedia. (2019). Primärer Kohlenstoff. Wiederhergestellt von: en.wikipedia.org



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.