
Polarität (Chemie) polare Moleküle und Beispiele
Das chemische Polarität Es ist eine Eigenschaft, die durch das Vorhandensein einer ausgeprägten heterogenen Verteilung der Elektronendichten in einem Molekül gekennzeichnet ist. In seiner Struktur gibt es daher negativ geladene Bereiche (δ-) und andere positiv geladene (δ +), die ein Dipolmoment erzeugen.
Das Bindungsdipolmoment (µ) ist eine Möglichkeit, die Polarität eines Moleküls auszudrücken. Es wird normalerweise als Vektor dargestellt, dessen Ursprung in der Ladung (+) liegt und dessen Ende in der Ladung (-) liegt, obwohl einige Chemiker es umgekehrt darstellen.
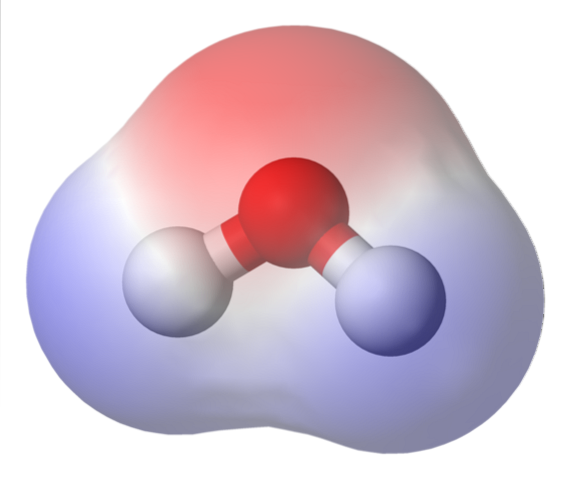
Das obere Bild zeigt die elektrostatische Potentialkarte für Wasser H.zweiO. Die rötliche Region (Sauerstoffatom) entspricht der Region mit der höchsten Elektronendichte, und es ist auch zu erkennen, dass sie sich von den blauen Regionen (Wasserstoffatomen) abhebt..
Da die Verteilung dieser Elektronendichte heterogen ist, wird gesagt, dass es einen positiven und einen negativen Pol gibt. Deshalb ist von chemischer Polarität und Dipolmoment die Rede.
Artikelverzeichnis
- 1 Dipolmoment
- 1.1 Asymmetrie im Wassermolekül
- 2 polare Moleküle
- 3 Beispiele
- 3.1 SO2
- 3,2 CHCl 3
- 3.3 HF
- 3,4 NH3
- 3.5 Makromoleküle mit Heteroatomen
- 4 Referenzen
Dipolmoment
Das Dipolmoment µ wird durch die folgende Gleichung definiert:
µ = δd
Wobei δ die elektrische Ladung jedes Pols ist, positiv (+ δ) oder negativ (-δ), und d ist der Abstand zwischen ihnen.
Das Dipolmoment wird normalerweise in Debye ausgedrückt, dargestellt durch das Symbol D. Ein Coulomb · Meter entspricht 2,998 · 1029 D..
Der Wert des Dipolmoments der Bindung zwischen zwei verschiedenen Atomen steht in Beziehung zum Unterschied der Elektronegativitäten der Atome, die die Bindung bilden..
Damit ein Molekül polar ist, reicht es nicht aus, polare Bindungen in seiner Struktur zu haben, sondern es muss auch eine asymmetrische Geometrie aufweisen. so, dass verhindert wird, dass die Dipolmomente Vektoren voneinander aufheben.
Asymmetrie im Wassermolekül
Das Wassermolekül hat zwei O-H-Bindungen. Die Geometrie des Moleküls ist eckig, dh in Form eines "V"; Die Dipolmomente der Bindungen heben sich also nicht gegenseitig auf, sondern es entsteht eine Summe, die auf das Sauerstoffatom zeigt.
Die elektrostatische Potentialkarte für H.zweiOder reflektieren Sie dies.
Wenn das Winkelmolekül H-O-H beobachtet wird, kann sich die folgende Frage stellen: Ist es wirklich asymmetrisch? Wenn eine imaginäre Achse durch das Sauerstoffatom gezogen wird, teilt sich das Molekül in zwei gleiche Hälften: H-O | O-H.
Dies ist jedoch nicht der Fall, wenn die imaginäre Achse horizontal ist. Wenn diese Achse das Molekül nun wieder in zwei Hälften teilt, haben wir das Sauerstoffatom auf der einen Seite und die beiden Wasserstoffatome auf der anderen Seite..
Aus diesem Grund ist die scheinbare Symmetrie des H.zweiOder es hört auf zu existieren und wird daher als asymmetrisches Molekül angesehen.
Polare Moleküle
Polare Moleküle müssen eine Reihe von Eigenschaften erfüllen, wie z.
-Die Verteilung der elektrischen Ladungen in der Molekülstruktur ist asymmetrisch.
-Sie sind normalerweise wasserlöslich. Dies liegt daran, dass polare Moleküle durch Dipol-Dipol-Kräfte interagieren können, wobei Wasser durch ein großes Dipolmoment gekennzeichnet ist.
Darüber hinaus ist seine Dielektrizitätskonstante sehr hoch (78,5), was es ihm ermöglicht, die elektrischen Ladungen getrennt zu halten, was seine Löslichkeit erhöht..
-Im Allgemeinen haben polare Moleküle hohe Siede- und Schmelzpunkte.
Diese Kräfte bestehen aus der Dipol-Dipol-Wechselwirkung, den Londoner Dispersionskräften und der Bildung von Wasserstoffbrücken..
-Polare Moleküle können aufgrund ihrer elektrischen Ladung Elektrizität leiten.
Beispiele
SWzwei
Schwefeldioxid (SOzwei). Sauerstoff hat eine Elektronegativität von 3,44, während die Elektronegativität von Schwefel 2,58 beträgt. Daher ist Sauerstoff elektronegativer als Schwefel. Es gibt zwei S = O-Bindungen, wobei die O eine δ-Ladung und die S a δ-Ladung aufweist+.
Da es sich um ein Winkelmolekül mit S am Scheitelpunkt handelt, sind die beiden Dipolmomente in die gleiche Richtung ausgerichtet. und deshalb addieren sie sich und bilden das SO-Molekülzwei sei polar.
CHCl3
Chloroform (HCCl3). Es gibt eine C-H-Bindung und drei C-Cl-Bindungen.
Die Elektronegativität von C beträgt 2,55 und die Elektronegativität von H beträgt 2,2. Somit ist Kohlenstoff elektronegativer als Wasserstoff; und daher wird das Dipolmoment von H (δ +) nach C (δ-) ausgerichtet: C.δ--H.δ+.
Im Fall von C-Cl-Bindungen hat C eine Elektronegativität von 2,55, während Cl eine Elektronegativität von 3,16 hat. Der Dipolvektor oder das Dipolmoment ist in den drei C-Bindungen von C nach Cl ausgerichtet δ+-Cl δ-.
Da es eine elektronenarme Region um das Wasserstoffatom gibt und eine elektronenreiche Region, die aus den drei Chloratomen besteht, CHCl3 wird als polares Molekül angesehen.
HF
Fluorwasserstoff hat nur eine H-F-Bindung. Die Elektronegativität von H beträgt 2,22 und die Elektronegativität von F beträgt 3,98. Daher hat Fluor die höchste Elektronendichte, und die Bindung zwischen beiden Atomen lässt sich am besten beschreiben als: H.δ+-F.δ-.
NH3
Ammoniak (NH3) hat drei NH-Bindungen. Die Elektronegativität von N beträgt 3,06 und die Elektronegativität von H beträgt 2,22. In allen drei Bindungen ist die Elektronendichte auf Stickstoff ausgerichtet und aufgrund des Vorhandenseins eines Paares freier Elektronen sogar noch höher.
Das NH-Molekül3 es ist tetraedrisch, wobei das N-Atom den Scheitelpunkt einnimmt. Die drei Dipolmomente, die den NH-Bindungen entsprechen, sind in die gleiche Richtung ausgerichtet. In ihnen befindet sich δ- im N und δ + im H. Somit sind die Bindungen: N.δ--H.δ+.
Diese Dipolmomente, die Asymmetrie des Moleküls und das freie Elektronenpaar auf Stickstoff machen Ammoniak zu einem hochpolaren Molekül..
Makromoleküle mit Heteroatomen
Wenn die Moleküle sehr groß sind, ist es nicht mehr sicher, sie selbst als unpolar oder polar zu klassifizieren. Dies liegt daran, dass es Teile seiner Struktur geben kann, die sowohl unpolare (hydrophobe) als auch polare (hydrophile) Eigenschaften aufweisen..
Diese Arten von Verbindungen sind als Amphiphile oder Amphipathika bekannt. Da der unpolare Teil in Bezug auf den polaren Teil als elektronenarm angesehen werden kann, ist in der Struktur eine Polarität vorhanden, und amphiphile Verbindungen werden als polare Verbindungen angesehen..
Es ist allgemein zu erwarten, dass ein Makromolekül mit Heteroatomen Dipolmomente und damit chemische Polarität aufweist..
Unter Heteroatomen werden solche verstanden, die sich von denen unterscheiden, aus denen das Gerüst der Struktur besteht. Beispielsweise ist das Kohlenstoffgerüst biologisch das wichtigste von allen, und das Atom, mit dem Kohlenstoff (zusätzlich zu Wasserstoff) eine Bindung eingeht, wird als Heteroatom bezeichnet..
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Prof. Krishnan. (2007). Polare und unpolare Verbindungen. St. Louis Community College. Wiederhergestellt von: users.stlcc.edu
- Murmson, Serm. (14. März 2018). Wie man die Polarität erklärt. Wissenschaft. Wiederhergestellt von: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (5. Dezember 2018). Definition und Beispiele für polare Bindungen (polare kovalente Bindung). Wiederhergestellt von :oughtco.com
- Wikipedia. (2019). Chemische Polarität. Wiederhergestellt von: en.wikipedia.org
- Quimitube. (2012). Kovalente Bindung: Bindungspolarität und molekulare Polarität. Wiederhergestellt von: quimitube.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.