
Was ist Molalität? (mit Beispielen)
Das Molalität, Mit dem Kleinbuchstaben m bezeichnet, beschreibt er die Konzentration einer Lösung. Es kann als die Anzahl der Mol eines gelösten Stoffes definiert werden, der in 1 Kilogramm Lösungsmittel gelöst ist.
Es ist gleich den Molen gelösten Stoffes (der Substanz, die sich auflöst) geteilt durch die Kilogramm Lösungsmittel (die Substanz, die zum Auflösen verwendet wird)..
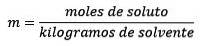
Wo die Mol gelösten Stoffes durch die Gleichung gegeben sind:
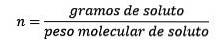
Am Ende lautet also die Molalitätsgleichung

Artikelverzeichnis
- 1 Merkmale der Molalität
- 2 Unterschiede und Ähnlichkeiten zwischen Molalität (m) und Molarität (M)
- 3 Beispiele für Molalität
- 3.1 Beispiel 1:
- 3.2 Beispiel 2:
- 3.3 Beispiel 3:
- 4 Referenzen
Eigenschaften der Molalität
Die Molalität ist ein Maß für die Konzentration eines gelösten Stoffes in einer Lösung. Wird hauptsächlich verwendet, wenn die Temperatur ein Problem darstellt.

Die Molalität ist nicht so häufig wie die Molarität (Mol gelöster Stoff pro Liter Lösungsmittel), wird jedoch in sehr spezifischen Berechnungen verwendet, insbesondere im Hinblick auf die kolligativen Eigenschaften (Siedepunkterhöhung, Siedepunkterniedrigung) des Gefrierens..
Da das Volumen aufgrund von Temperatur und Druck Schwankungen unterliegt, variiert die Molarität auch je nach Temperatur und Druck. In einigen Fällen ist die Verwendung von Gewicht ein Vorteil, da die Masse nicht mit den Umgebungsbedingungen variiert..
Es ist wichtig, dass die Masse des Lösungsmittels verwendet wird und nicht die Masse der Lösung. Mit Molkonzentration markierte Lösungen sind mit einem Kleinbuchstaben m gekennzeichnet. Eine 1,0 m Lösung enthält 1 Mol gelösten Stoff pro Kilogramm Lösungsmittel.
Die Herstellung einer Lösung mit einer bestimmten Molalität ist einfach, da nur ein guter Maßstab erforderlich ist. Sowohl Lösungsmittel als auch gelöster Stoff werden gemischt und nicht nach Volumen gemessen.
Die SI-Einheit (International System) für die Molalität ist Mol / kg oder Mol gelöster Stoff pro kg Lösungsmittel. Eine Lösung mit einer Molalität von 1 Mol / kg wird oft als "1 Mol" oder "1 m" beschrieben..
Nach dem SI-Einheitensystem betrachtet das National Institute of Standards and Technology, die US-amerikanische Behörde für Messung, den Begriff "molal" und das Einheitensymbol "m" als veraltet und schlägt die Verwendung von mol / kg vor.
Unterschiede und Ähnlichkeiten zwischen Molalität (m) und Molarität (M)
Die Herstellung einer Lösung einer gegebenen Molalität beinhaltet das Abwiegen sowohl des gelösten Stoffes als auch des Lösungsmittels und das Erhalten ihrer Massen..
Im Fall der Molarität wird jedoch das Volumen der Lösung gemessen, was Raum für Dichteschwankungen aufgrund der Umgebungsbedingungen von Temperatur und Druck lässt..
Dies bedeutet, dass es vorteilhaft ist, mit der Molalität zu arbeiten, die sich mit der Masse befasst, da in der chemischen Zusammensetzung die Masse einer bekannten Reinsubstanz wichtiger ist als ihr Volumen, da die Volumina unter dem Einfluss von Temperatur und Druck verändert werden können, während die Masse bleibt unverändert.
Darüber hinaus finden chemische Reaktionen proportional zur Masse und nicht zum Volumen statt. Um auf der Masse zu basieren, kann die Molalität leicht in ein Massenverhältnis oder einen Massenanteil umgewandelt werden.
Bei wässrigen Lösungen (Lösungen, in denen Wasser das Lösungsmittel ist) nahe Raumtemperatur ist der Unterschied zwischen molaren und molaren Lösungen vernachlässigbar..
Dies liegt daran, dass Wasser bei Raumtemperatur eine Dichte von 1 kg / l hat. Dies bedeutet, dass das "pro l" der Molarität gleich dem "pro kg" der Molalität ist..
Für ein Lösungsmittel wie Ethanol mit einer Dichte von 0,789 kg / l wäre eine 1 M Lösung 0,789 m.
Der wichtige Teil, um sich an den Unterschied zu erinnern, ist:
Molarität - M → Mol pro Liter Lösung.
Molalität - m → Mol pro Kilogramm Lösungsmittel.
Beispiele für Molalität
Beispiel 1:
Problem: Wie hoch ist die Molalität einer Lösung, die 0,086 Mol NaCl enthält, gelöst in 25,0 g Wasser??
Antworten: In diesem Beispiel wird die direkte Molalitätsgleichung verwendet:
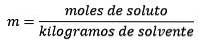
Mol gelöster Stoff (NaCl) = 0,086 Mol
Masse (Wasser) = 25,0 g = 25,0 × 10-3 kg
Ersatz haben wir:
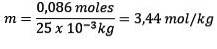
Beispiel 2:
Problem: Was ist die Molalität einer Lösung, wenn 124,2 g NaOH in 1,00 Litern Wasser gelöst sind? (Die Dichte des Wassers beträgt 1,00 g / ml).
Antworten: Wasser ist als universelles Lösungsmittel bekannt und die Dichte wird normalerweise mit 1,00 Gramm pro Milliliter oder 1 Kilogramm pro Liter angegeben. Dies erleichtert die Umrechnung von Litern in Kilogramm..
In diesem Problem müssen die 124,2 Gramm NaOH in Mol (für Mol gelösten Stoff) und ein Liter Wasser unter Verwendung der Dichte in Kilogramm (pro Kilogramm Lösungsmittel) umgewandelt werden.
Finden Sie zuerst die Molmasse von NaOH:
P.M.N / A= 22,99 g / mol
P.M.ODER= 16 g / mol
P.M.H.= 1 g / mol
P.M.NaOH= 22,99 g / mol + 16 g / mol + 1 g / mol = 39,99 g / mol
Zweitens wandeln Sie die Gramm NaOH unter Verwendung der Molmasse in Mol um:
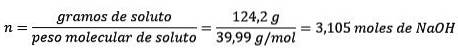
Drittens konvertieren Sie den Liter Wasser anhand der Dichte in Kilogramm.
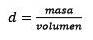
Das Lösen nach der Masse bleibt bestehen
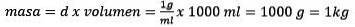
Schließlich ist die Molalitätsgleichung gelöst:
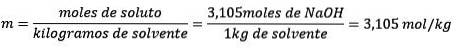
Beispiel 3:
Problem: Wie groß ist die Wassermasse einer wässrigen Lösung, die 0,52 g Bariumchlorid (BaCl) enthält?zwei, PM = 208,23 g / mol), deren Konzentration 0,005 mol / kg beträgt?
Antworten: In diesem Fall wird die Molkonzentration verwendet, um die Menge an Wasser in Lösung zu bestimmen.
Zunächst wird die Molzahl von BaCl erhaltenzwei in der Lösung:
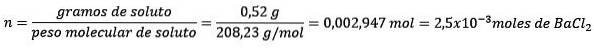
Zweitens entfernen Sie Kilogramm Lösungsmittel aus der Molalitätsgleichung und lösen nach.
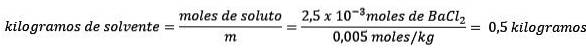
Verweise
- Wissenschaftliche Notizen und Projekte. (2015, 22. Februar). Beispiel für die Berechnung der Molalität Problem. Von sciencenotes.org wiederhergestellt.
- Bhardwaj, M. (2014, 26. November). Was ist ein Beispiel für Molalität?? Von socratic.org wiederhergestellt.
- (S.F.). Molalität. Von boundless.com wiederhergestellt.
- Helmenstine, T. (2017, 19. Februar). Was ist der Unterschied zwischen Molarität und Molalität?? Von gedankenco.com wiederhergestellt.
- Molalitätsformel. (S.F.). Von softschools.com wiederhergestellt.
- Molalität. (S.F.). Von chemteam.l wiederhergestellt
- Was ist Molalität?? (S.F.). Von freechemistryonline.com wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.