
Was ist die Reaktionswärme?

Das Reaktionswärme oder Reaktionsenthalpie (ΔH) ist die Änderung der Enthalpie einer chemischen Reaktion, die bei konstantem Druck auftritt. Es ist eine thermodynamische Maßeinheit, die nützlich ist, um die Energiemenge pro Mol zu berechnen, die bei einer Reaktion freigesetzt oder erzeugt wird.
Da die Enthalpie aus Druck, Volumen und innerer Energie abgeleitet wird, die alle Zustandsfunktionen sind, ist die Enthalpie auch eine Zustandsfunktion..
ΔH oder die Enthalpieänderung trat als Maßeinheit auf, um die Energieänderung eines Systems zu berechnen, wenn es zu schwierig wurde, das ΔU oder die Änderung der inneren Energie eines Systems zu finden, während gleichzeitig die Menge an Wärme und vertauschter Arbeit gemessen wurde.
Bei konstantem Druck entspricht die Enthalpieänderung der Wärme und kann als ΔH = q gemessen werden.
Die Notation ΔHº oder ΔHºr dann ergibt sich, um die genaue Temperatur und den Druck der Reaktionswärme ΔH zu erklären.
Die Standardreaktionsenthalpie wird durch ΔHº oder ΔHºrxn symbolisiert und kann sowohl positive als auch negative Werte annehmen. Die Einheiten für ΔHº sind KiloJoule pro Mol oder kj / Mol.
Vorheriges Konzept zum Verständnis der Reaktionswärme: Unterschiede zwischen ΔH und ΔHºr.
Δ = repräsentiert die Änderung der Enthalpie (Enthalpie der Produkte minus Enthalpie der Reaktanten).
Ein positiver Wert zeigt an, dass die Produkte eine höhere Enthalpie aufweisen oder dass es sich um eine endotherme Reaktion handelt (Wärme ist erforderlich)..
Ein negativer Wert zeigt an, dass die Reaktanten eine höhere Enthalpie haben oder dass es sich um eine exotherme Reaktion handelt (Wärme wird erzeugt)..
º = bedeutet, dass die Reaktion eine Standard-Enthalpieänderung ist und bei einem voreingestellten Druck / einer voreingestellten Temperatur stattfindet.
r = bedeutet, dass diese Änderung die Enthalpie der Reaktion ist.
Der Standardzustand: Der Standardzustand eines Feststoffs oder einer Flüssigkeit ist die reine Substanz bei einem Druck von 1 bar oder der gleichen 1 Atmosphäre (105 Pa) und einer Temperatur von 25 ° C oder der gleichen 298 K..
Das ΔHºr ist die Standardreaktionswärme oder Standardenthalpie einer Reaktion und misst als ΔH auch die Enthalpie einer Reaktion. ΔHºrxn findet jedoch unter "Standard" -Bedingungen statt, was bedeutet, dass die Reaktion bei 25ºC und 1 atm stattfindet..
Der Vorteil einer ΔH-Messung unter Standardbedingungen liegt in der Fähigkeit, einen ΔHº-Wert mit einem anderen in Beziehung zu setzen, da sie unter denselben Bedingungen auftreten.
Bildungswärme
Die Standardbildungswärme ΔHF.º eines chemischen Produkts ist die Wärmemenge, die bei der Bildung von 1 Mol dieser Chemikalie bei 25 Grad Celsius und 1 bar ihrer Elemente in ihren Standardzuständen absorbiert oder freigesetzt wird.
Ein Element befindet sich in seinem Standardzustand, wenn es in seiner stabilsten Form und in seinem physikalischen Zustand (fest, flüssig oder gasförmig) bei 25 Grad Celsius und 1 bar vorliegt.
Beispielsweise beinhaltet die Standardbildungswärme für Kohlendioxid Sauerstoff und Kohlenstoff als Reaktanten..
Sauerstoff ist stabiler als O-Gasmolekülezwei, während Kohlenstoff als fester Graphit stabiler ist. (Graphit ist unter Standardbedingungen stabiler als Diamant).
Um die Definition anders auszudrücken, ist die Standardbildungswärme eine spezielle Art der Standardreaktionswärme..
Die Reaktion ist die Bildung von 1 Mol einer Chemikalie aus ihren Elementen in ihren Standardzuständen unter Standardbedingungen.
Die Standard-Bildungswärme wird auch als Standard-Bildungsenthalpie bezeichnet (obwohl es sich tatsächlich um eine Änderung der Enthalpie handelt)..
Per Definition würde die Bildung eines Elements an sich keine Änderung der Enthalpie hervorrufen, sodass die Standardreaktionswärme für alle Elemente Null ist (Cai, 2014)..
Berechnung der Reaktionsenthalpie
1- Experimentelle Berechnung
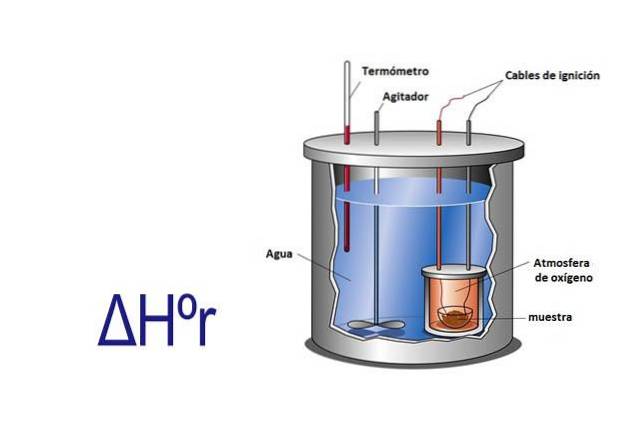
Die Enthalpie kann experimentell mit einem Kalorimeter gemessen werden. Ein Kalorimeter ist ein Instrument, bei dem eine Probe über elektrische Kabel reagiert, die die Aktivierungsenergie liefern. Die Probe befindet sich in einem Behälter, der von Wasser umgeben ist, das ständig gerührt wird.
Durch Messen der Temperaturänderung, die auftritt, wenn die Probe reagiert, und Kenntnis der spezifischen Wärme von Wasser und seiner Masse wird die durch die Reaktion freigesetzte oder absorbierte Wärme unter Verwendung der Gleichung q = Cesp x m x ΔT berechnet.
In dieser Gleichung ist q Wärme, Cesp ist die spezifische Wärme in diesem Fall von Wasser, die 1 Kalorie pro Gramm entspricht, m ist die Wassermasse und ΔT ist die Temperaturänderung.
Das Kalorimeter ist ein isoliertes System, das einen konstanten Druck hat, also ΔHr= q
2- Theoretische Berechnung
Die Enthalpieänderung hängt nicht vom jeweiligen Reaktionsweg ab, sondern nur vom globalen Energieniveau der Produkte und Reaktanten. Die Enthalpie ist eine Funktion des Zustands und als solche additiv.
Um die Standardenthalpie einer Reaktion zu berechnen, können wir die Standardbildungsenthalpien der Reaktanten addieren und von der Summe der Standardbildungsenthalpien der Produkte subtrahieren (Boundless, S.F.). Mathematisch ausgedrückt ergibt dies:
ΔHr° = Σ ΔHF.º (Produkte) - Σ ΔHF.º (Reaktanten).
Reaktionsenthalpien werden üblicherweise aus Enthalpien der Reaktantenbildung unter normalen Bedingungen (Druck von 1 bar und Temperatur 25 Grad Celsius) berechnet..
Um dieses Prinzip der Thermodynamik zu erklären, berechnen wir die Reaktionsenthalpie für die Verbrennung von Methan (CH)4) nach der Formel:
CH4 (g) + 20zwei (g) → COzwei (g) + 2HzweiO (g)
Um die Standardenthalpie der Reaktion zu berechnen, müssen wir die Standardbildungsenthalpien für jeden der an der Reaktion beteiligten Reaktanten und Produkte ermitteln..
Diese finden Sie normalerweise in einem Anhang oder in verschiedenen Online-Tabellen. Für diese Reaktion benötigen wir folgende Daten:
H.F.º CH4 (g) = -75 kjoul / mol.
H.F.º O.zwei (g) = 0 kjoul / mol.
H.F.º COzwei (g) = -394 kjoul / mol.
H.F.º H.zweiO (g) = -284 kjoul / mol.
Es ist zu beachten, dass die Standardbildungsenthalpie für Sauerstoffgas 0 kJ / mol beträgt, da es sich in seinem Standardzustand befindet.
Hier fassen wir unsere Standard-Bildungsenthalpien zusammen. Da die Einheiten in kJ / mol angegeben sind, müssen wir mit den stöchiometrischen Koeffizienten in der ausgeglichenen Reaktionsgleichung (Leaf Group Ltd, S.F.) multiplizieren..
Σ ΔHF.º (Produkte) = ΔHF.º COzwei +2 ΔHF.º H.zweiODER
Σ ΔHF.º (Produkte) = -1 (394 kjoul / mol) -2 (284 kjoul / mol) = -962 kjoul / mol
Σ ΔHF.º (Reaktanten) = ΔHF.º CH4 + ΔHF.º O.zwei
Σ ΔHF.º (Reaktanten) = -75 kjoul / mol + 2 (0 kjoul / mol) = -75 kjoul / mol
Nun können wir die Standardenthalpie der Reaktion finden:
ΔHr° = Σ ΔHF.º (Produkte) - Σ ΔHF.º (Reaktanten) = (- 962) - (- 75) =
ΔHr° = - 887 kJ / mol.
Verweise
- Anne Marie Helmenstine. (2014, 11. Juni). Definition der Reaktionsenthalpie. Vonoughtco wiederhergestellt :oughtco.com.
- (S.F.). Standardreaktionsenthalpie. Von boundless wiederhergestellt: boundless.com.
- Cai, E. (2014, 11. März). Standard Formationswärme. Von Chemicalstatistician wiederhergestellt: Chemicalstatistician.wordpress.com.
- Clark, J. (2013, Mai). Verschiedene Enthalpieänderungsdefinitionen. Von chemguide.co.uk wiederhergestellt: chemguide.co.uk.
- Jonathan Nguyen, G. L. (2017, 9. Februar). Standard-Bildungsenthalpie. Von chem.libretexts.org wiederhergestellt: chem.libretexts.org.
- Leaf Group Ltd. (S.F.). Wie man Reaktionsenthalpien berechnet. Von sciencing wiederhergestellt: sciencing.com.
- Rachel Martin, E. Y. (2014, 7. Mai). Reaktionswärme. Von chem.libretexts.org wiederhergestellt: chem.libretexts.org.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.