
Potentiometer (pH-Meter) Wofür es ist und wie es funktioniert

EIN Potentiometer ist die Vorrichtung, die verwendet wird, um die Potentialdifferenz zwischen einer Arbeits- und einer Referenzelektrode zu messen, wenn beide in eine Lösung eingetaucht sind, deren Säure oder Basizität bestimmt werden soll, wobei dies als pH ausgedrückt wird.
Auf diese Weise bezieht sich die Potentiometrie auf die Analysemethode zur Bestimmung der Konzentration von H-Ionen.+ in einer Substanz, die in Lösung ist, unter Verwendung eines Potentiometers und der beiden vorgenannten Elektroden.

Im Fall der Referenzelektrode hat sie im Gegensatz zur Arbeitselektrode ein bekanntes, konstantes und stabiles Potential. Das Potential, das sich in dieser letzten Elektrode entwickelt, variiert proportional zur Konzentration der H-Ionen+ das sind in der Lösung.
Dieses Potential wird auch stark von der Temperatur beeinflusst, bei der die Messung durchgeführt wird..
Artikelverzeichnis
- 1 Wofür ist es??
- 2 Wie funktioniert es??
- 2.1 Elektroden
- 2.2 Potentiometer kalibrieren
- 3 Referenzen
Wofür ist das?
Es gibt eine große Anzahl von Prozessen, die im industriellen Bereich durchgeführt werden - wie Arzneimittelherstellung, Lebensmittelverarbeitung und Wasserreinigung - und die sehr empfindlich auf Schwankungen des pH-Werts reagieren. Aus diesem Grund ist die korrekte Messung so wichtig.
Wie zuvor erwähnt, ist der pH ein Parameter, der verwendet wird, um den Säuregehalt oder die Alkalität einer Lösung, die sich in der wässrigen Phase befindet, durch Analyse der Konzentration von H-Ionen zu messen.+ in Lösung. Dann wird der pH-Wert durch die folgende Gleichung berechnet:
pH = -log [H.+]]
Das Potentiometer wird also verwendet, um den pH-Wert einer Substanz in Lösung zu messen..
Wenn das Potentiometer an die beiden Elektroden angeschlossen wird, die in die zu analysierende Lösung eingetaucht sind, erfasst es die Potentialdifferenz zwischen der Arbeitselektrode und der Referenzelektrode, verstärkt dieses Signal und wandelt es unter Verwendung der oben beschriebenen Gleichung in einen pH-Wert um..
Wie funktioniert es?
Der Betrieb eines Potentiometers basiert auf dem Mechanismus einer elektrochemischen Zelle, an der H-Ionen beteiligt sind+ bei der chemischen Reaktion der Zelle, um die Konzentration dieser Ionen in der Lösung zu bestimmen und auf diese Weise den pH-Wert derselben zu erhalten.
Wenn der pH-Wert einer Lösung potentiometrisch gemessen werden soll, werden ein Potentiometer und eine Elektrode verwendet; Das erste ist das Gerät, das den pH-Wert bestimmt, während das zweite auf der Kombination einer Referenzelektrode und einer Messelektrode basiert, die gegenüber Analyten empfindlich ist.
In diesem Sinne wird eine Schaltung gebildet, durch die der elektrische Strom zwischen den Elektroden und der Lösung fließt, wo sie die Funktion einer Batterie erfüllen, wenn sie in die erwähnte Lösung eingetaucht sind..
Auf diese Weise ist das Potentiometer so ausgelegt, dass bei einem pH-Wert von sieben eine Spannung von Null (in Millivolt-Einheiten) erzeugt wird. das heißt, neutral.
Wenn ein Anstieg der Potentialwerte (mit positiven Zahlen) registriert wird, bedeutet dies ebenfalls, dass es niedrigere pH-Werte gibt, und wenn ein Rückgang beobachtet wird - das heißt ein Wachstum in Richtung negativer Zahlen -, sprechen wir von höheren Werten. PH.
Elektroden
Die Messelektrode (oder Arbeitselektrode) besteht aus einem Gerät, in dem die untersuchte Reaktion (Oxidation oder Reduktion) stattfindet.
Obwohl es viele Arten gibt, handelt es sich im Allgemeinen um Glas, das aus einer sehr dünnen Glasmembran besteht, die für H-Ionen durchlässig ist.+ der Umgebung, in der es ist.
Indem dies in eine Lösung gegeben wird, deren pH-Wert sich von dem der in der Zelle vorhandenen Lösung unterscheidet, wird eine Potentialdifferenz zwischen den beiden Seiten der Membran erzeugt, und diese Differenz kann mittels einer Referenzelektrode aufgezeichnet werden..
Andererseits ist die Referenzelektrode eine Vorrichtung mit Eigenschaften eines stabilen Potentials und mit einem bekannten Wert, die normalerweise als Anode in der elektrochemischen Zelle verwendet wird..
Ein Beispiel für diesen Elektrodentyp besteht aus einem Silberdraht, der mit Silberchlorid beschichtet und in eine verdünnte Salzsäurelösung getaucht ist, oder einer mit Kalomel gesättigten Referenzelektrode, wie in der folgenden Abbildung gezeigt.
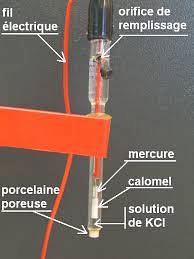
Das Potentiometer bestimmt also die Potentialdifferenz, die zwischen den Elektroden erzeugt wird, obwohl nur das Potential der Arbeitselektrode von den Konzentrationen der ionischen Spezies abhängt..
Potentiometer kalibrieren
Die Kalibrierung eines Potentiometers muss mit bekannten Pufferlösungen (auch Puffer oder Pufferlösungen genannt) durchgeführt werden, die aus Systemen mit praktisch unveränderlichem pH-Wert bestehen, die eine schwache Substanz und ihre konjugierten Spezies enthalten..
Jeder Puffer hat einen spezifischen pH-Wert, der sauer sein kann (pH<7), básico (pH>7) oder neutral (pH = 7) und kann im Handel bereits standardisiert gekauft oder im Labor mit zertifizierten Reagenzien und unter Verwendung etablierter und validierter Verfahren hergestellt werden..
Da Potentiometer den pH-Wert in einem Bereich messen, der als breit angesehen wird, muss bekannt sein, ob der Analyt einen pH-Wert von mehr oder weniger als sieben aufweist, um mit der korrekten Kalibrierung fortzufahren..
Daher sollte für Proben, deren pH-Wert voraussichtlich basisch ist, eine Pufferlösung mit einem pH-Wert von sieben und eine andere mit einem höheren pH-Wert kalibriert werden (normalerweise wird einer mit einem pH-Wert von zehn verwendet)..
Andererseits wird für Proben mit einem erwarteten sauren pH-Wert eine Pufferlösung mit einem pH-Wert von sieben und eine andere mit einem niedrigeren pH-Wert kalibriert (normalerweise wird ein pH-Wert von vier verwendet)..
Schließlich muss die Neukalibrierung dieses Messgeräts vor und nach jedem Gebrauch durchgeführt werden, wobei die Ergebnisse einschließlich Datum und Uhrzeit ihrer Durchführung sowie die Eigenschaften der zur Steuerung verwendeten Pufferlösungen aufgezeichnet werden müssen..
Verweise
- Wikipedia. (s.f.). pH-meter. Erhalten von es.wikipedia.org
- Chang, R. (2007). Chemie, 9. Auflage. (McGraw-Hill).
- Westcott, C. (2012). PH-Messungen. Erhalten von books.google.co.ve
- Nielsen, C. (1996). Verwaltung des analytischen Labors: Schlicht und einfach. Erhalten von books.google.co.ve
- Kenkel, J. (2010). Analytische Chemie für Techniker, 3. Auflage. Erhalten von books.google.co.ve
- Cable, M. (2005). Kalibrierung: Ein Technikerhandbuch. Erhalten von books.google.co.ve



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.