
Calciumsulfid (CaS) -Struktur, Eigenschaften, Herstellung, Verwendung

Das Calciumsulfid Es ist ein anorganischer Feststoff, der aus dem Element Calcium (Ca) und dem Element Schwefel (S) gebildet wird. Die chemische Formel lautet CaS. Es ist ein gelblich-weißer Feststoff, der in Wasser löslich ist und in der Natur in einigen Vulkanen und in einigen Meteoriten in Form eines Minerals namens Oldhamit vorkommt..
Wenn sich CaS in Wasser löst, bildet es aufgrund des Sulfidions S verschiedene Verbindungenzwei- wird zu Ion SH- und OH-Ionen werden gebildet-. Die resultierende Lösung ist alkalisch. Diese Verbindung wird als Basis für Verbindungen verwendet, die lumineszierend sind oder unter bestimmten Bedingungen sichtbares Licht erzeugen. Diese Materialien werden auch in Leuchtfarben verwendet.

CaS wurde als mögliches Medikament zur Behandlung von Herz- und Blutgefäßproblemen wie Bluthochdruck oder Bluthochdruck angesehen, einer Krankheit, von der ein großer Teil der Weltbevölkerung betroffen ist.
Mit Calciumsulfid können andere Verbindungen wie Calciumnitrat und Calciumcarbonat erhalten werden. Es muss mit Vorsicht behandelt werden und in Kontakt mit der Luftfeuchtigkeit, die H erzeugen kannzweiS das ist sehr giftig.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Physikalische Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Dichte
- 3.5 Löslichkeit
- 4 Chemische Eigenschaften
- 4.1 Wässrige Lösung
- 4.2 Verbindungen, die in Wasser gelöst sind
- 4.3 Reaktion mit Säuren
- 4.4 Andere Reaktionen
- 5 Erhalten
- 5.1 Präsenz in der Natur
- 6 Verwendungen
- 6.1 In leuchtenden Materialien
- 6.2 In der Medizin
- 6.3 Bei der Gewinnung anderer Verbindungen
- 6.4 Andere Anwendungen
- 7 Risiken
- 8 Referenzen
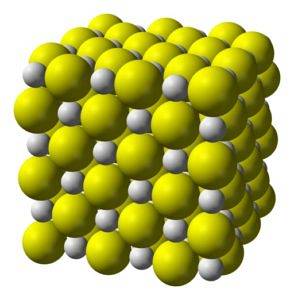
Struktur
Calciumsulfid ist eine hochionische Verbindung, die von einem Calciumion Ca gebildet wirdzwei+ und ein Sulfidion S.zwei-.
Kristallisiert zu einer kubischen Struktur wie Steinsalz.
Nomenklatur
- Calciumsulfid
Physikalische Eigenschaften
Körperlicher Status
Gelblich-weiße kristalline feste, kubische Kristalle wie die von Natriumchlorid.
Molekulargewicht
72,144 g / mol
Schmelzpunkt
2528 ºC
Dichte
2,59 g / cm3
Löslichkeit
In Wasser löslich. Unlöslich in Ethanol.
Chemische Eigenschaften
Wässrige Lösung
Wenn sich CaS in Wasser löst, trennt es sich in seine Calcium-Ca-Ionen. zwei+ und Schwefel S.zwei-. Letzteres nimmt in Wasser ein Proton auf und wird zum Hydrosulfidion SH- Freisetzung eines Hydroxylions OH-.
S.zwei- + H.zweiO ⇔ SH- + Oh-
Daher sind Calciumsulfid-CaS-Lösungen alkalisch (haben einen basischen pH-Wert) und keine S-Ionen.zwei- aber SH-.
Nur wenn der Lösung eine große Menge Alkali wie Natriumhydroxid NaOH zugesetzt wird, verschiebt sich das Gleichgewicht in Richtung der Bildung von Sulfidionen S.zwei-.

Der SH- kann ein anderes Proton H nehmen+ aus Wasser unter Bildung von Schwefelwasserstoff, der eine sehr giftige Verbindung ist.
Sch- + H.zweiO ⇔ H.zweiS + OH-
Aus diesem Grund werden in Wasser geringe Mengen an H gebildet.zweiJa, und wenn CaS der Luftfeuchtigkeit ausgesetzt ist, riecht es unangenehm nach Schwefelwasserstoff.
Verbindungen, die in Wasser gelöst sind
Das Ergebnis der oben angegebenen Reaktionen in Wasser ist, dass Ca (SH) gebildet wirdzwei, Ca (OH)zwei und Ca (SH) (OH).
CaS + H.zweiO → Ca (SH) (OH)
Ca (SH) (OH) + H.zweiO → Ca (OH)zwei + H.zweiS.
Reaktion mit Säuren
Die gleichen Reaktionen, die in Wasser auftreten, bewirken, dass CaS mit Säuren reagiert, die H bildenzweiS..
CaS + 2 HCl → CaClzwei + H.zweiS.
Andere Reaktionen
Wenn eine Calciumsulfidlösung mit Schwefel erhitzt wird, werden die Polysulfidionen S erhalten.4zwei- und S.3zwei-.
Wenn CaS in trockener Luft oder reinem Sauerstoff erhitzt wird, oxidiert die Verbindung zu Calciumsulfit CaSO3 und dann zu Calciumsulfat CaSO4::
2 CaS + 3 O.zwei → 2 CaSO3
2 CaSO3 + ODERzwei → 2 CaSO4
Mit Oxidationsmitteln wie Kaliumchlorat KClO3, Kaliumnitrat KNO3 oder Bleidioxid PbOzwei Es treten heftige Reaktionen auf.
Erhalten
Calciumsulfid kann hergestellt werden, indem die Elemente Calcium (Ca) und Schwefel (S) in einer inerten Atmosphäre kalziniert (auf eine sehr hohe Temperatur erhitzt) werden, dh es ist beispielsweise kein Sauerstoff oder Wasserdampf vorhanden..
Ca + S + Wärme → CaS
Es kann auch durch Erhitzen von Calciumsulfat CaSO erhalten werden4 mit Holzkohle:
Fall4 + 2 C → CaS + 2 COzwei
Im letzteren Fall wird jedoch kein reines CaS erhalten, da es zusätzlich mit CaSO reagiert4 Bildung von CaO und SOzwei.
CaS wird auch durch Verbrennen von Kohlenabfällen erzeugt.
Präsenz in der Natur
CaS ist natürlich im Mineral Oldhamit enthalten. Dies ist ein Bestandteil einiger Meteoriten und wichtig für die wissenschaftliche Forschung am Sonnensystem..
Es wird angenommen, dass sich Oldhamit durch Kondensation im Nebel gebildet hat, aus dem das Sonnensystem stammt. Es ist auch in Vulkanen vorhanden.

Zusätzlich wird Calciumsulfid auf natürliche Weise durch Reduktion von CaSO hergestellt4 (Gips) möglicherweise aufgrund der Einwirkung von Bakterien.
Anwendungen
In leuchtenden Materialien
Eine der am weitesten verbreiteten Anwendungen von Calciumsulfid war die Basis für Lumineszenzverbindungen. Dies sind Substanzen, die unter bestimmten Umständen sichtbares Licht emittieren..
In den Lumineszenzverbindungen von CaS wirkt dies als Base und der Struktur werden Aktivatoren wie Chloride bestimmter Elemente wie Cer (Ce) zugesetzt3+) und Europium (Euzwei+).
Das Material, das aus der Vereinigung von CaS und Aktivator resultiert, wird beispielsweise in Kathodenstrahlröhrenbildschirmen verwendet, aus denen die alten Bildschirme von Computern oder Computern oder alten Fernsehgeräten bestehen.

Sie werden auch in aktuellen Leuchtdioden- oder LED-Lampen verwendet. Leuchtdioden).

Diese Materialien werden auch in Leuchtfarben und -lacken verwendet..
In Behandlung
Calciumsulfid wurde in medizinisch-wissenschaftlichen Studien als Medikament zur Behandlung von Bluthochdruck (Bluthochdruck in den Arterien) in Betracht gezogen. Dies ist eine Krankheit, die das Herz-Kreislauf-System vieler Menschen (Herz und Blutgefäße) betrifft..
CaS wird als "Spender" von H angesehenzweiS. Dies spielt eine wichtige Rolle bei der Regulierung des Tons oder der Stärke von Blutgefäßen, so dass die Verabreichung von CaS ein mögliches Mittel zur Behandlung von Bluthochdruck sein könnte.

Bei der Gewinnung anderer Verbindungen
Calciumsulfid ermöglicht die Herstellung anderer Verbindungen wie Calciumnitrat Ca (NO3)zwei::
CaS + 2 HNO3 → Ca (NR3)zwei + H.zweiS.
Es wurde auch verwendet, um Calciumcarbonat CaCO zu erhalten3. Zu diesem Zweck wird eine wässrige CaS-Lösung mit CO karbonisiertzwei::
CaS + H.zweiO + COzwei → H.zweiS + CaCO3
Andere Apps
Calciumsulfid wird auch als Schmiermitteladditiv und als Flotationsmittel bei der Mineralextraktion verwendet..
Risiken
Calciumsulfid kann Haut-, Augen- und Atemwegsreizungen verursachen. Es muss mit Vorsicht und mit angemessener Sicherheitsausrüstung behandelt werden.
Es ist eine sehr giftige Verbindung für Wasserlebewesen, daher ist es für diese Umgebungen gefährlich.
Verweise
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- Lide, D.R. (Editor). (2005). CRC Handbuch für Chemie und Physik. 85th CRC Drücken Sie.
- Ropp, R.C. (2013). Erdalkaliverbindungen der Gruppe 16 (O, S, Se, Te). Calciumsulfid. In der Enzyklopädie der Erdalkaliverbindungen. Von sciencedirect.com wiederhergestellt.
- Li, Y.F. et al. (2009). Calciumsulfid (CaS), ein Donor von Schwefelwasserstoff (H (2) S): ein neues blutdrucksenkendes Medikament? Med Hypotheses, 2009 Sep; 73 (3): 445 & ndash; 7. Von ncbi.nlm.nih.gov wiederhergestellt.
- Haus J.E. und House, K.A. (2016). Schwefel, Selen und Tellur. Vorkommen von Schwefel. In Descriptive Anorganic Chemistry (Dritte Auflage). Von sciencedirect.com wiederhergestellt.
- UNS. Nationalbibliothek für Medizin. (2019). Calciumsulfid. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- De Beer, M. et al. (2014). Umwandlung von Calciumsulfid in Calciumcarbonat während des Prozesses der Rückgewinnung von elementarem Schwefel aus Gipsabfällen. Waste Manag, 2014 Nov; 34 (11): 2373 & ndash; 81. Von ncbi.nlm.nih.gov wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.