
Struktur, Funktionen und Beispiele von Nukleoproteinen
EIN Nukleoprotein Es ist jede Art von Protein, das strukturell mit einer Nukleinsäure assoziiert ist - entweder RNA (Ribonukleinsäure) oder DNA (Desoxyribonukleinsäure). Die bekanntesten Beispiele sind Ribosomen, Nukleosomen und Nukleokapside in Viren..
Ein Protein, das an DNA bindet, kann jedoch nicht als Nukleoprotein angesehen werden. Diese zeichnen sich durch die Bildung stabiler Komplexe und nicht durch eine einfache vorübergehende Assoziation aus - wie die Proteine, die die DNA-Synthese und den DNA-Abbau vermitteln und kurz und kurz miteinander interagieren..
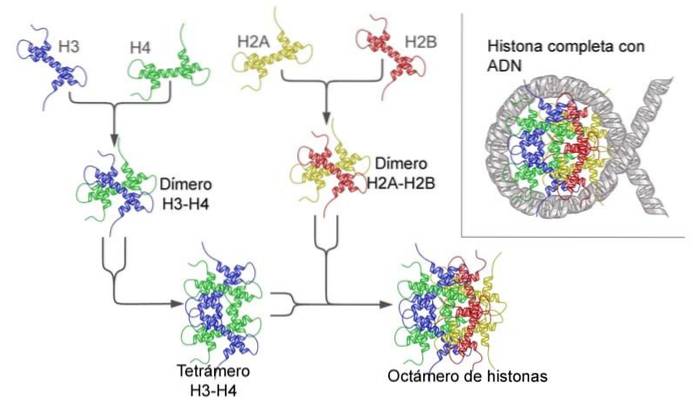
Die Funktionen von Nukleoproteinen variieren stark und hängen von der zu untersuchenden Gruppe ab. Beispielsweise ist die Hauptfunktion von Histonen die Verdichtung von DNA zu Nukleosomen, während Ribosomen an der Synthese von Proteinen beteiligt sind..
Artikelverzeichnis
- 1 Struktur
- 2 Art der Interaktion
- 3 Klassifikation und Funktionen
- 3.1 Desoxyribonukleoproteine
- 3.2 Ribonukleoproteine
- 4 Beispiele
- 4.1 Histone
- 4.2 Protamine
- 4.3 Ribosomen
- 5 Referenzen
Struktur
Im Allgemeinen bestehen Nukleoproteine aus einem hohen Prozentsatz basischer Aminosäurereste (Lysin, Arginin und Histidin). Jedes Nukleoprotein hat seine eigene Struktur, aber alle konvergieren, um Aminosäuren dieses Typs zu enthalten.
Bei physiologischem pH-Wert sind diese Aminosäuren positiv geladen, was die Interaktion mit den Molekülen des genetischen Materials fördert. Als nächstes werden wir sehen, wie diese Wechselwirkungen auftreten.
Art der Interaktion
Nukleinsäuren bestehen aus einem Rückgrat aus Zuckern und Phosphaten, die ihnen eine negative Ladung verleihen. Dieser Faktor ist der Schlüssel zum Verständnis der Wechselwirkung von Nukleoproteinen mit Nukleinsäuren. Die Bindung, die zwischen Proteinen und genetischem Material besteht, wird durch nichtkovalente Bindungen stabilisiert.
Ebenso stellen wir nach den Grundprinzipien der Elektrostatik (Coulombsches Gesetz) fest, dass Ladungen mit unterschiedlichen Vorzeichen (+ und -) anziehen.
Die Anziehungskraft zwischen den positiven und negativen Ladungen der Proteine und des genetischen Materials führt zu unspezifischen Wechselwirkungen. Im Gegensatz dazu treten spezifische Übergänge in spezifischen Sequenzen auf, wie beispielsweise ribosomale RNA..
Es gibt verschiedene Faktoren, die die Wechselwirkungen zwischen dem Protein und dem genetischen Material verändern können. Zu den wichtigsten zählen die Salzkonzentrationen, die die Ionenstärke in der Lösung erhöhen; ionogene Tenside und andere chemische Verbindungen polarer Natur, wie beispielsweise Phenol, Formamid.
Klassifikation und Funktionen
Nukleoproteine werden nach der Nukleinsäure klassifiziert, an die sie gebunden sind. Somit können wir zwischen zwei genau definierten Gruppen unterscheiden: Desoxyribonukleoproteine und Ribonukleoproteine. Logischerweise die erstere Ziel-DNA und die letztere RNA.
Desoxyribonukleoproteine
Die wichtigste Funktion von Desoxyribonukleoproteinen ist die Verdichtung von DNA. Die Zelle steht vor einer Herausforderung, die kaum zu bewältigen scheint: Fast zwei Meter DNA werden ordnungsgemäß in einen mikroskopischen Kern gewickelt. Dieses Phänomen kann dank der Existenz von Nukleoproteinen erreicht werden, die den Strang organisieren.
Diese Gruppe ist unter anderem auch mit regulatorischen Funktionen bei Replikationsprozessen, DNA-Transkription und homologer Rekombination verbunden..
Ribonukleoproteine
Ribonukleoproteine erfüllen ihrerseits wesentliche Funktionen, die von der DNA-Replikation über die Regulation der Genexpression bis hin zur Regulation des zentralen RNA-Metabolismus reichen..
Sie hängen auch mit Schutzfunktionen zusammen, da Messenger-RNA in der Zelle niemals frei ist, da sie zum Abbau neigt. Um dies zu vermeiden, assoziieren eine Reihe von Ribonukleoproteinen mit diesem Molekül in Schutzkomplexen..
Das gleiche System findet sich in Viren, die ihre RNA-Moleküle vor der Wirkung von Enzymen schützen, die sie abbauen könnten.
Beispiele
Histone
Histone entsprechen der Proteinkomponente von Chromatin. Sie sind in dieser Kategorie am bekanntesten, obwohl wir auch andere an DNA gebundene Proteine finden, die keine Histone sind und zu einer großen Gruppe gehören, die als nicht-histonische Proteine bezeichnet wird.
Strukturell sind sie die grundlegendsten Proteine im Chromatin. Und unter dem Gesichtspunkt der Fülle sind sie proportional zur DNA-Menge.
Wir haben fünf Arten von Histonen. Seine Klassifizierung basierte historisch auf dem Gehalt an basischen Aminosäuren. Histonklassen sind unter eukaryotischen Gruppen praktisch unveränderlich.
Diese evolutionäre Erhaltung wird der enormen Rolle zugeschrieben, die Histone in organischen Wesen spielen.
Wenn sich die Sequenz, die für Histon kodiert, ändert, hat der Organismus schwerwiegende Konsequenzen, da seine DNA-Verpackung fehlerhaft ist. Somit ist die natürliche Selektion dafür verantwortlich, diese nicht funktionellen Varianten zu eliminieren.
Unter den verschiedenen Gruppen sind die Histone H3 und H4 am konserviertesten. Tatsächlich sind die Sequenzen in Organismen so weit voneinander entfernt - phylogenetisch gesehen - wie bei einer Kuh und einer Erbse..
Die DNA wickelt sich in das sogenannte Histonoctamer ein, und diese Struktur ist das Nukleosom - die erste Stufe der Verdichtung von genetischem Material..
Protamine
Protamine sind kleine Kernproteine (bei Säugetieren bestehen sie aus einem Polypeptid mit fast 50 Aminosäuren), die sich durch einen hohen Gehalt an Aminosäureresten Arginin auszeichnen. Die Hauptaufgabe von Protaminen besteht darin, Histone in der haploiden Phase der Spermatogenese zu ersetzen.
Es wurde vorgeschlagen, dass diese Arten von basischen Proteinen für die Verpackung und Stabilisierung von DNA im männlichen Gameten entscheidend sind. Sie unterscheiden sich von Histonen dadurch, dass sie eine dichtere Packung ermöglichen.
Bei Wirbeltieren wurden 1 bis 15 codierende Sequenzen für Proteine gefunden, die alle auf demselben Chromosom gruppiert sind. Der Sequenzvergleich legt nahe, dass sie sich aus Histonen entwickelt haben. Die am meisten untersuchten Säugetiere heißen P1 und P2.
Ribosomen
Das auffälligste Beispiel für Proteine, die an RNA binden, sind Ribosomen. Sie sind Strukturen, die in praktisch allen Lebewesen vorhanden sind - von kleinen Bakterien bis zu großen Säugetieren.
Ribosomen haben die Hauptfunktion, die RNA-Nachricht in eine Aminosäuresequenz zu übersetzen.
Sie sind eine hochkomplexe molekulare Maschinerie, die aus einer oder mehreren ribosomalen RNAs und einer Reihe von Proteinen besteht. Wir können sie frei im Zellzytoplasma finden oder im rauen endoplasmatischen Retikulum verankern (tatsächlich ist der „raue“ Aspekt dieses Kompartiments auf Ribosomen zurückzuführen)..
Es gibt Unterschiede in der Größe und Struktur der Ribosomen zwischen eukaryotischen und prokaryotischen Organismen..
Verweise
- T. A. Baker, J. D. Watson, S. P. Bell, A. Gann, M. A. Losick & R. Levine (2003). Molekularbiologie des Gens. Benjamin-Cummings Verlag.
- Balhorn, R. (2007). Die Protaminfamilie der Spermienkernproteine. Genombiologie, 8(9), 227.
- J. E. Darnell, H. F. Lodish & D. Baltimore (1990). Molekulare Zellbiologie. Wissenschaftliche amerikanische Bücher.
- Jiménez García, L. F. (2003). Zell- und Molekularbiologie. Pearson Education of Mexico.
- Lewin, B (2004). Gene VIII. Pearson Prentice Hall.
- Teijón, J. M. (2006). Grundlagen der Strukturbiochemie. Editorial Tébar.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.