
Ordnungszahl
Was ist die Ordnungszahl?
Die Ordnungszahl eines chemischen Elements gibt die Anzahl der Protonen an, die im Atomkern dieses Elements enthalten sind. In dem Fall, dass es sich um ein neutrales Atom handelt, stimmt die Ordnungszahl mit der Anzahl der Elektronen des Elements überein.
Bekanntlich besteht der Atomkern aus Protonen und Neutronen. Protonen haben eine positive Ladung und ihr Wert stimmt mit dem absoluten Wert der negativen Ladung des Elektrons überein, der 1,6 x 10 beträgt-19 Coulomb in Einheiten des Internationalen Systems.
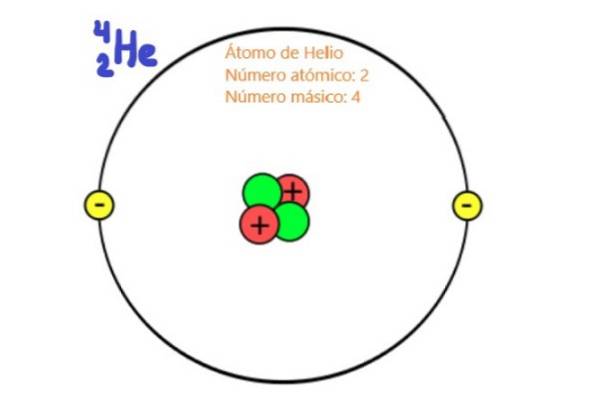
Da es sich um Teilchen des Atomkerns handelt, sind Protonen und Neutronen bekannt als Nukleonen. Es sind diese Teilchen, die praktisch die Masse des Atoms bestimmen, da die Nukleonen etwa zweitausendmal massereicher sind als die Elektronen des Atoms. Aus diesem Grund wird die Anzahl der Nukleonen in einem Atom genannt Massenzahl.
Die Ordnungszahl es ist dasjenige, das die chemische Affinität der atomaren Elemente bestimmt, weil diese Zahl in neutralen Atomen mit der Anzahl der Elektronen übereinstimmt.
Ordnungszahldarstellung
Im Periodensystem wird das Symbol X eines chemischen Elements unten links von der Zahl Z begleitet, die die Ordnungszahl des Elements darstellt, während die Massenzahl oben links im chemischen Symbol des Elements angegeben ist. ZU.
Die folgende Abbildung zeigt diese Notation:
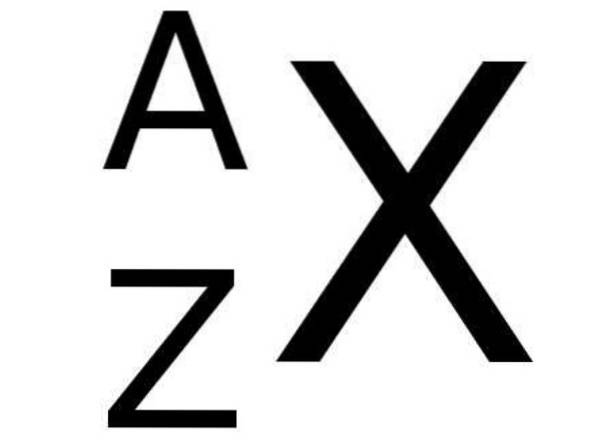
Und unten zeigt Tabelle 1 einige Beispiele für chemische Elemente mit ihrer jeweiligen Notation sowie Atom- und Massenzahlen:
Tabelle 1
| Element | Notation | Ordnungszahl Z. | Massennummer A. |
|---|---|---|---|
| Wasserstoff | 1 1 H. | 1 | 1 |
| Kohlenstoff | 12 6 C. | 6 | 12 |
| Sauerstoff | 16 8 ODER | 8 | 16 |
| Uran | 238 92 ODER | 92 | 238 |
Ordnungszahl und Reihenfolge der Elemente im Periodensystem
Das Periodensystem der chemischen Elemente ermöglicht die sequentielle Anordnung und in aufsteigender Reihenfolge der Elemente entsprechend dem Wert ihrer Ordnungszahl.
Mindestens 118 von ihnen sind bekannt, beginnend mit Wasserstoff bis zum Erreichen des Elements 118, das das ist Oganeson -vorher angerufen Ununoctium-, dessen chemisches Symbol Og ist und dessen Massenzahl 294 ist.
Die ersten 10 chemischen Elemente mit zunehmender Ordnungszahl in der Ordnungszahl sind viel vertrauter. So haben wir zum Beispiel das bekannteste:
- Wasserstoff, H.
- Helium, er
- Lithium, Li
- Beryllium, Be
- Bor, B.
- Kohlenstoff, C.
- Stickstoff, N.
- Sauerstoff, O.
- Fluor, F.
- Neon, Ne

Elektronische Konfiguration
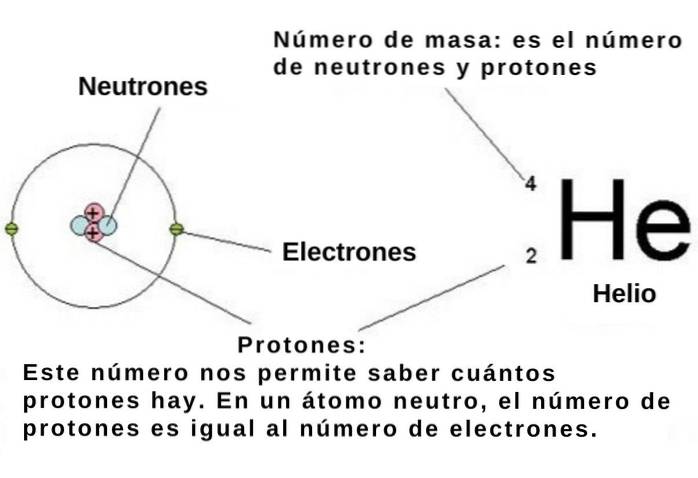
Die Ordnungszahl gibt die Anzahl der Protonen im Atomkern eines chemischen Elements an, und jedes Proton hat, wie gesagt, eine positive Elementarladung von 1.602 x 10-19 C..
Wenn das Atom neutral ist, beträgt die Anzahl der negativ geladenen Elementarelektronen -1,602 x 10-19 C muss gleich der Ordnungszahl sein. Wenn man also die numerische Position eines chemischen Elements im Periodensystem kennt, ist auch seine Anzahl von Elektronen bekannt..
Im Atom besetzen diese Elektronen die genannten Regionen Orbitale, die von der Energie und dem Drehimpuls des Elektrons abhängen. Im Gegenzug werden sowohl die Energie als auch der Drehimpuls der Elektronen im Atom quantisiert. Dies bedeutet, dass sie nur einige diskrete Werte annehmen können.
Jetzt sind die Orbitale mit Elektronen von niedrigerer bis höherer Energie besiedelt, wobei bestimmte Regeln befolgt werden, die die elektronische Konfiguration bestimmen.
Auf diese Weise stellt die Anzahl der Elektronen in den äußersten Orbitalen oder Ebenen eines Atoms die Bindungen her, die es mit anderen Atomen bilden kann, um Moleküle zu bilden. Diese Zahl hängt von der Elektronenkonfiguration und der Ordnungszahl ab.
Quantenzahlen
Die Energie eines Elektrons im Atom wird durch seine Hauptquantenzahl bestimmt n, die ganzzahlige Werte 1, 2, 3 annehmen können ...
Der Drehimpuls des Elektrons im Atom wird durch die sekundäre Quantenzahl bestimmt l (Buchstabe ele) und seine Werte hängen von n ab.
Zum Beispiel nimmt für n = 2 die sekundäre Quantenzahl die Werte von 0 bis n-1 an, dh: 0 und 1. In ähnlicher Weise ist für n = 1, das das niedrigste Energieniveau ist, die sekundäre Quantenzahl nur l nimmt den Wert 0 an.
Sekundärquantenzahlen 0, 1, 2, 3 werden abwechselnd mit den Buchstaben s, p, d und f bezeichnet. Die s-Orbitale sind kugelförmig und die p-Orbitale sind lobuliert.
Es gibt zwei weitere Quantenzahlen:
- Die magnetische Quantenzahl ml, Dies nimmt die Werte von -l bis + l an, die durch Null gehen.
- Die Spinquantenzahl s, Das nimmt nur Werte + ½ und -½ an und ist ein Merkmal des Elektrons.
Schließlich gibt es das Pauli-Ausschlussprinzip, das besagt, dass zwei Elektronen nicht alle vier identischen Quantenzahlen haben können. Infolge dieses Prinzips kann ein Orbital maximal zwei Elektronen mit entgegengesetztem Spin haben.
Elektronisches Konfigurationsdiagramm
Das Elektronenkonfigurationsdiagramm wird verwendet, um die Reihenfolge der Füllung der Elektronen von den Orbitalen mit der niedrigsten Energie zu den Orbitalen mit der höchsten Energie zu kennen, sobald die Ordnungszahl eines chemischen Elements bekannt ist. Abbildung 4 zeigt dieses Diagramm:
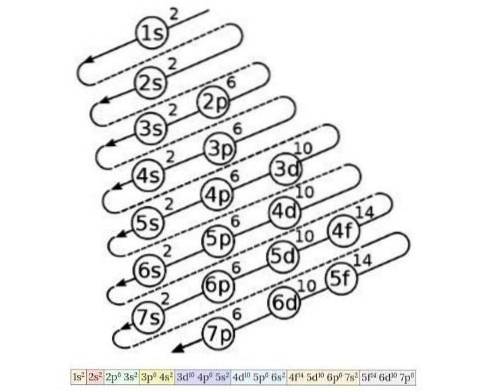
Die dort skizzierte Idee lautet wie folgt: Die erste Zahl gibt die Hauptquantenzahl an, der Buchstabe die sekundäre Quantenzahl und schließlich die hochgestellte Zahl die maximal mögliche Anzahl von Elektronen in diesem Orbital..
Beispiel
Elektronische Konfiguration von Kohlenstoff und Silizium
Wie oben angegeben, hat Kohlenstoff die Ordnungszahl 6, was bedeutet, dass er 6 Elektronen hat, die wie folgt verteilt sind: 1s2 2s2 2p2. Silizium hat seinerseits die Ordnungszahl 14 und seine Elektronen sind auf folgende Weise verteilt: 1s2 2s2 2p6 3s2 3p2.
Beide Elemente befinden sich in derselben Spalte des Periodensystems, da sie, obwohl sie unterschiedliche Ordnungszahlen haben, dieselbe elektronische Konfiguration im Periodensystem haben. äußerste Umlaufbahn.
Verweise
- Connor, N. Was ist Nucleon - Struktur des Atomkerns - Definition. Wiederhergestellt von: periodic-table.org.
- Volksgipfel. Ordnungszahl: Was ist das, wie wird es dargestellt? Wiederhergestellt von: cumbrepuebloscop20.org
- Lifeder. Was ist chemische Periodizität? Wiederhergestellt von: lifeder.com
- Wikipedia. Elektronische Konfiguration. Wiederhergestellt von: es.wikipedia.com
- Wikipedia. Ordnungszahl. Wiederhergestellt von: es.wikipedia.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.