
Molaritätskonzentration, Einheiten, Berechnung, Übungen
Das Molarität ist die Konzentration einer Lösung, ausgedrückt in Mol gelösten Stoffes pro Liter Lösung. Es wird als M abgekürzt und drückt eine Beziehung zwischen der Masse des gelösten Stoffes und dem Volumen der Lösung (m / v) aus; obwohl traditionell diese Beziehung als Gewicht zu Volumen ausgedrückt wird.
Ein Mol ist die Anzahl der Atome oder Moleküle, die im Atom- oder Molekulargewicht enthalten sind; Es wird in Gramm / Mol ausgedrückt. Ein Mol entspricht 6,02 · 102. 3 Atome oder Moleküle, bekannt als Avogadro-Zahl.
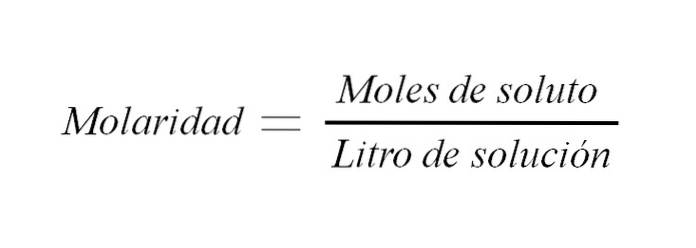
Es gibt andere Möglichkeiten, die Beziehung zwischen der Masse eines gelösten Stoffs und dem Volumen auszudrücken, einschließlich: der prozentualen Beziehung zwischen der Masse des gelösten Stoffs und dem Volumen der Lösung und der Normalität. Letzteres wird als Anzahl der Äquivalente eines gelösten Stoffes pro Liter Lösung ausgedrückt.
Währenddessen drückt die Molalität, die als die Anzahl der Mol pro Kilogramm Lösungsmittel, üblicherweise Wasser, definiert ist, eine Beziehung zwischen der Masse des gelösten Stoffes und der Masse des Lösungsmittels (m / m) aus..
Die Form des Ausdrucks der Konzentration einer Lösung in ppm (parts per million) drückt eine Beziehung zwischen einem Teil des gelösten Stoffes und einer Million Teilen der Lösung aus und wird im Allgemeinen verwendet, um eine Masse-Masse-Beziehung (m / m) auszudrücken. . Sie können jedoch eine Masse-Volumen-Beziehung (m / v) ausdrücken..
Die molare Konzentration kann nicht nur in Mol pro Liter ausgedrückt werden, sondern auch in Millimol / Liter (Millimolarlösung); Mikromol / Liter (mikromolare Lösung); usw.
Molaritätsprobleme können mit einer Analysemethode und der "Dreierregel" gelöst werden. Die Wahl einer Methode hängt von der Fähigkeit ab, eine der Methoden anzuwenden.
Artikelverzeichnis
- 1 molare Konzentration
- 2 Einheiten
- 3 Berechnung der Molarität?
- 4 Gehen Sie von der Molarität zur Molalität
- 4.1 Erster Schritt
- 4.2 Zweiter Schritt
- 4.3 Dritter Schritt
- 4.4 Vierter Schritt
- 4.5 Fünfter Schritt
- 4.6 Numerisches Beispiel
- 5 Probleme gelöst
- 5.1 Problem 1
- 5.2 Problem 2
- 5.3 Problem 3
- 5.4 Problem 4
- 5.5 Problem 5
- 6 Referenzen
Molare Konzentration
Es wird verwendet, um die Konzentration eines gelösten Stoffes in einem gegebenen Volumen der Lösung auszudrücken.
M = n / V (1)
Wenn M gleich der Molarität ist, ist n die Anzahl der Mol und V das Volumen der Lösung. Die Molarität einer Lösung ist also die Anzahl der Mol gelösten Stoffes pro Volumen der Lösung, ausgedrückt in Litern.
Andererseits ist die Anzahl der Mol
n = m / PM (2)
Wobei m die Masse des gelösten gelösten Stoffes und PM seine Molmasse ist.
Einsetzen von (2) in (1):
M = (m / PM) / V.
Einheiten
Die Einheit im internationalen System für die molare Konzentration ist mol / m3. Dies entspricht einer millimolaren Lösung, weil am3 entspricht 1.000 Litern. In den Bereichen Chemie und Biologie wird die molare Konzentration üblicherweise als Mol / L ausgedrückt. Diese Einheit wird mit dem M (Großbuchstaben) ausgedrückt..
Eine Lösung von einem Mol / l entspricht einer Lösung M; eine Lösung von 10-3 Mol / l entspricht 1 mM (Millimolar); und eine Lösung von 10-6 Mol / l entspricht 1 uM (mikromolar).
Wie berechnet man die Molarität??
Es ist zweckmäßig, die oben angegebenen Ausdrücke zu verwenden, da dies sicherstellt, dass das Ergebnis der Anwendung der Formel in Mol / Liter ergibt, was die Definition der molaren Konzentration ist.
Um die Molarität einer Lösung zu berechnen, muss die Konzentration des gelösten Stoffes in g / l ausgedrückt werden. Dann wird das Molekulargewicht des gelösten Stoffes (g / mol) ermittelt und das Verhältnis zwischen der Konzentration und dem Molekulargewicht ermittelt. Das erhaltene Ergebnis ist die in Mol / Liter ausgedrückte Molarität.
Gehen Sie von der Molarität zur Molalität
Eine notwendige Information, um von der Molarität zur Molalität zu gelangen, ist die Kenntnis der Dichte der Lösung. Dies ermöglicht die Kenntnis der Masse der Lösung, eine wesentliche Voraussetzung für die Berechnung der Molalität..
Erster Schritt
Zuerst muss man von der molaren Konzentration auf Gramm / Liter umsteigen. Dazu reicht es aus, die Molarität der Lösung mit dem Molekulargewicht des gelösten Stoffes zu multiplizieren..
Gramm / Liter gelöster Stoff = Molarität (Mol / Liter) · Molekulargewicht des gelösten Stoffes (Gramm / Mol).
Dies ermöglicht es, die Masse des gelösten Stoffes in 1 l Lösung zu erhalten.
Zweiter Schritt
Dann ist es notwendig, die Masse der Lösung zu berechnen. Hierzu wird die Dichte verwendet. Normalerweise wird die Dichte in Gramm / Kubikzentimeter oder Milliliter ausgedrückt.
Masse der Lösung (g) = Volumen der Lösung (ml) Dichte (g / ml)
Dritter Schritt
Erhalten der Masse des Lösungsmittels. Da die Masse der Lösung gleich der Masse des gelösten Stoffes plus der Masse des Lösungsmittels ist, reicht es aus, die Masse des gelösten Stoffes (Schritt 1) von der Masse der Lösung zu subtrahieren, um die Masse des gelösten Stoffes zu erhalten (Schritt 1) Schritt 2)..
Vierter Schritt
Schließlich muss die gelöste Masse (g) der Lösung auf die gelöste Masse übertragen werden, die 1.000 g oder 1 kg Lösungsmittel entspricht. Um dies zu tun, würde es ausreichen, eine einfache Regel von drei oder eine andere äquivalente mathematische Operation durchzuführen.
Fünfter Schritt
Teilen Sie g gelösten Stoff / 1000 g Lösungsmittel durch das Molekulargewicht des gelösten Stoffes (g / mol), um die Molalität der Lösung zu erhalten.
Numerisches Beispiel
Eine 3 M Glucoselösung (Molekulargewicht 180 g / mol) hat eine Dichte von 1,15 g / ml. Berechnen Sie die Molalität dieser Lösung.
Wir berechnen zuerst die Gramm Glukose, die in einem Liter Lösung gelöst sind:
g / l = 3 Mol / l 180 g / mol
= 540 g / l
Als nächstes berechnen wir die Masse der Lösung aus ihrer Dichte:
g Lösung (Masse) = 1.000 ml 1,15 g / ml
= 1.150 g
Die Masse des Lösungsmittels ergibt sich aus der Differenz:
Masse des Lösungsmittels = Masse der Lösung - Masse des gelösten Stoffes
= 1.150 g - 540 g
= 610 g
610 g sind jedoch nicht 1000 g Lösungsmittel, wie in der Definition der Molalität festgelegt. Daher muss berechnet werden, wie viele Gramm Glucose in 1000 g Lösungsmittel gelöst sind:
Masse des gelösten Stoffes = 540 g gelöster Stoff (1000 g Lösungsmittel / 610 g Lösungsmittel)
= 885,25 g
Und schließlich wird die Molalität berechnet, indem die Gramm in Mol zurückgegeben werden:
Molalität = (885,25 g gelöster Stoff / 180 g / mol)
= 4,92 mol gelöster Stoff / kg Lösungsmittel
= 4,92 m
Probleme gelöst
Problem 1
Wie viel Kupfersulfat wird benötigt, um 500 ml einer 0,4 M Lösung herzustellen? Drücken Sie das Ergebnis in Gramm aus. Molekulargewicht von Kupfersulfat (CuSO4): 160 g / mol.
Wir bestimmen zunächst die Mol, die in einer solchen Lösung gelöst werden müssen:
M = n / V.
n = M V.
n = (0,4 mol / l) 0,5 l
= 0,2 Mol
Wenn man dann die Anzahl der Mol Kupfersulfat kennt, kann seine Masse erhalten werden
n = m / PM
m = nmolekulargewicht
m = 0,2 mol 160 g / mol
= 32 g CuSO4
Das heißt, 32 g dieses Salzes müssen in 500 ml Lösungsmittel gelöst werden.
Problem 2
Welches Volumen einer Lösung wird benötigt, damit sich 0,4 Mol gelöster Stoff in einer Konzentration von 0,25 M auflösen?
Das Volumen der Lösung ergibt sich aus dem Konzept der Molarität
M = n / V.
V = n / M.
V = 0,4 Mol / (0,25 Mol / l)
= 1,6 l
Dies bedeutet, dass die Lösung ein Volumen von 1,6 Litern haben muss, um eine solche Konzentration von 0,25 M zu erhalten.
Problem 3
Eine Masse von 8 g Natriumhydroxid (NaOH) wird in 60 g einer Lösung mit einer Dichte von 1,6 g / ml gelöst. Was ist die Molarität der Lösung? Natriumhydroxid-Molekulargewicht: 40 g / mol.
Die Mol NaOH müssen zuerst berechnet werden:
n = m / PM
= 8 g Natriumhydroxid / (40 g / mol)
= 0,2 Mol
Nun berechnen wir das Volumen der Lösung:
m = V d
v = 60 g / (1,6 g / ml)
v = 37,5 ml
Um die Molarität zu erhalten, muss das Volumen der Lösung in Litern angegeben werden:
V = 37,5 ml 10-3 L / ml
= 0,0375 l
M = 0,2 Mol / 0,0375 l
5,33 Mol / l
5,33 M.
Problem 4
Berechnen Sie die Molarität einer Salzsäurelösung (HCl) mit einer Dichte von 1,25 g / ml und einer Konzentration von 35%, ausgedrückt Masse / Masse. Salzsäure-Molekulargewicht: 36,5 g / mol.
Bestimmen Sie die Masse von 35% iger Salzsäure
m = V d
m = 1.000 ml 1,25 g / ml
= 1.250 g
Aber nicht alles ist HCl, es gibt auch Wasser:
Masse HCl = 1.250 g (35/100)
= 437,5 g
Das ist das gleiche wie zu sagen, dass in einem Liter 35% iger HCl-Lösung 437,5 g HCl enthalten sind.
Dann werden die Mol HCl berechnet, um die Molarität sofort zu bestimmen:
n = m / PM
n = (437,5 g / l) / (36,5 g / mol)
= 11,98 Mol / l
Molarität = 11,98 M.
Problem 5
Berechnen Sie die Molarität einer Lösung, die 5 g NaCl in 2 l Lösung enthält. Natriumchlorid-Molekulargewicht: 58,5 g / mol.
Die Mol / l NaCl können in einem einzigen Schritt erhalten werden:
Molarität = (5 g NaCl / 2 l Lösung) x (1 Mol NaCl / 58,5 g NaCl)
= 0,043 mol / l
Molarität = 0,043 M.
Ein anderes Verfahren könnte sein:
g / l NaCl = 5 g / 2 l
= 2,5 g / l
Mol / l = (2,5 g / l) / (58,5 g / mol)
= 0,043 mol / l
= 0,043 M.
Verweise
- Rodríguez, M. (2007). Chemie. Salesianische Redaktionsstiftung
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Wikipedia. (2019). Molarität Wiederhergestellt von: es.wikipedia.org
- Atarés Huerta. (s.f.). Molarität und Molalität. [PDF]. Wiederhergestellt von: riunet.upv.es
- Softchools. (2019). Molaritätsformel. Wiederhergestellt von: softschools.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.