
Ammoniumionen (NH4 +) Formel, Eigenschaften und Verwendungen

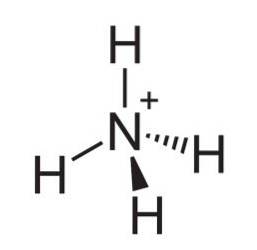
Das Ammoniumion ist ein positiv geladenes mehratomiges Kation, dessen chemische Formel NH ist4+. Das Molekül ist nicht flach, sondern wie ein Tetraeder geformt. Die vier Wasserstoffatome bilden die vier Ecken.
Ammoniakstickstoff hat ein ungeteiltes Elektronenpaar, das ein Proton (Lewis-Base) aufnehmen kann, daher wird das Ammoniumion durch Protonierung von Ammoniak gemäß der Reaktion gebildet: NH3 + H.+ → NH4+
Der Name Ammonium wird auch für substituierte Amine oder substituierte Ammoniumkationen verwendet. Beispielsweise ist Methylammoniumchlorid ein ionisches Salz der Formel CH3NH4Cl, wo das Chloridion an ein Methylamin gebunden ist.
Das Ammoniumion hat Eigenschaften, die den schwereren Alkalimetallen sehr ähnlich sind, und wird oft als enger Verwandter angesehen. Es wird erwartet, dass sich Ammonium bei sehr hohen Drücken wie ein Metall verhält, beispielsweise in Gasriesenplaneten wie Uranus und Neptun..
Das Ammoniumion spielt eine wichtige Rolle bei der Proteinsynthese im menschlichen Körper. Kurz gesagt, alle Lebewesen benötigen Proteine, die aus etwa 20 verschiedenen Aminosäuren bestehen. Während Pflanzen und Mikroorganismen die meisten Aminosäuren aus Stickstoff in der Atmosphäre synthetisieren können, können Tiere dies nicht..
Für den Menschen können einige Aminosäuren überhaupt nicht synthetisiert werden und müssen als essentielle Aminosäuren konsumiert werden.
Andere Aminosäuren können jedoch von Mikroorganismen im Magen-Darm-Trakt mit Hilfe von Ammoniakionen synthetisiert werden. Somit ist dieses Molekül eine Schlüsselfigur im Stickstoffkreislauf und in der Proteinsynthese..
Artikelverzeichnis
- 1 Eigenschaften
- 1.1 Löslichkeit und Molekulargewicht
- 1.2 Säure-Base-Eigenschaften
- 1.3 Ammoniumsalze
- 2 Verwendungen
- 3 Referenzen
Eigenschaften
Löslichkeit und Molekulargewicht
Das Ammoniumion hat ein Molekulargewicht von 18,039 g / mol und eine Löslichkeit von 10,2 mg / ml Wasser (Nationales Zentrum für Biotechnologie-Informationen, 2017). Das Auflösen von Ammoniak in Wasser bildet das Ammoniumion gemäß der Reaktion:
NH3 + H.zweiO → NH4+ + Oh-
Dies erhöht die Hydroxylkonzentration im Medium durch Erhöhen des pH-Werts der Lösung (Royal Society of Chemistry, 2015)..
Säure-Base-Eigenschaften
Das Ammoniumion hat einen pKb von 9,25. Dies bedeutet, dass es bei einem pH-Wert über diesem Wert ein saures Verhalten und bei einem niedrigeren pH-Wert ein basisches Verhalten aufweist..
Wenn beispielsweise Ammoniak in Essigsäure gelöst wird (pKa = 4,76), entnimmt das freie Elektronenpaar Stickstoff dem Medium ein Proton, wodurch die Konzentration der Hydroxidionen gemäß der folgenden Gleichung erhöht wird:
NH3 + CH3COOH ⇌ NH4+ + CH3GURREN-
In Gegenwart einer starken Base wie Natriumhydroxid (pKa = 14,93) liefert das Ammoniumion dem Medium entsprechend der Reaktion ein Proton:
NH4+ + NaOH ⇌ NH3 + N / A+ + H.zweiODER
Zusammenfassend wird bei einem pH-Wert von weniger als 9,25 Stickstoff protoniert, während er bei einem pH-Wert über diesem Wert deprotoniert wird. Dies ist von größter Bedeutung für das Verständnis der Titrationskurven und des Verhaltens von Substanzen wie Aminosäuren..
Ammoniumsalze
Eine der charakteristischsten Eigenschaften von Ammoniak ist seine Fähigkeit, sich je nach Reaktion direkt mit Säuren zu Salzen zu verbinden:
NH3 + HX → NH4X.
So bildet es mit Salzsäure Ammoniumchlorid (NH4Cl); Mit Salpetersäure Ammoniumnitrat (NH4NICHT3) bildet mit Kohlensäure Ammoniumcarbonat ((NH4)zweiCO3) usw.
Es wurde gezeigt, dass sich perfekt trockenes Ammoniak nicht mit perfekt trockener Salzsäure verbindet, da die Feuchtigkeit notwendig ist, um die Reaktion auszulösen (VIAS Encyclopedia, 2004)..
Die meisten einfachen Ammoniumsalze sind in Wasser sehr gut löslich. Eine Ausnahme bildet Ammoniumhexachloroplatinat, dessen Bildung als Test für Ammonium verwendet wird. Die Salze von Ammoniumnitrat und insbesondere Perchlorat sind hochexplosiv, in diesen Fällen ist Ammonium das Reduktionsmittel.
In einem ungewöhnlichen Prozess bilden die Ammoniumionen ein Amalgam. Solche Spezies werden durch Elektrolyse einer Ammoniumlösung unter Verwendung einer Quecksilberkathode hergestellt. Dieses Amalgam zersetzt sich schließlich unter Freisetzung von Ammoniak und Wasserstoff (Johnston, 2014).
Eines der häufigsten Ammoniumsalze ist Ammoniumhydroxid, bei dem es sich einfach um in Wasser gelöstes Ammoniak handelt. Diese Verbindung ist sehr verbreitet und kommt auf natürliche Weise in der Umwelt (in Luft, Wasser und Boden) sowie in allen Pflanzen und Tieren, einschließlich Menschen, vor..
Anwendungen
Ammonium ist eine wichtige Stickstoffquelle für viele Pflanzenarten, insbesondere für solche, die in hypoxischen Böden wachsen. Es ist jedoch auch für die meisten Pflanzenarten toxisch und wird selten als einzige Stickstoffquelle verwendet (Database, Human Metabolome, 2017)..
Stickstoff (N), der an Proteine in toter Biomasse gebunden ist, wird von Mikroorganismen verbraucht und in Ammoniumionen (NH4 +) umgewandelt, die direkt von Pflanzenwurzeln (z. B. Reis) absorbiert werden können..
Ammoniumionen werden normalerweise von Nitrosomonas-Bakterien in Nitrit-Ionen (NO2-) umgewandelt, gefolgt von einer zweiten Umwandlung von Nitrobacter-Bakterien in Nitrat (NO3-)..
Die drei wichtigsten Stickstoffquellen in der Landwirtschaft sind Harnstoff, Ammonium und Nitrat. Die biologische Oxidation von Ammonium zu Nitrat wird als Nitrifikation bezeichnet. Dieser Prozess umfasst mehrere Schritte und wird durch obligate aerobe, autotrophe Bakterien vermittelt..
In überfluteten Böden ist die Oxidation von NH4 + eingeschränkt. Harnstoff wird durch das Enzym Urease abgebaut oder chemisch zu Ammoniak und CO2 hydrolysiert.
Im Ammonifizierungsschritt wird das Ammoniak durch Ammonisieren von Bakterien in das Ammoniumion (NH4 +) umgewandelt. Im nächsten Schritt wird das Ammonium durch Nitrifikation von Bakterien in Nitrat umgewandelt (Nitrifikation).
Diese hochmobile Form von Stickstoff wird am häufigsten von Pflanzenwurzeln sowie von Mikroorganismen im Boden absorbiert..
Um den Stickstoffkreislauf zu schließen, wird Stickstoffgas in der Atmosphäre von Rhizobium-Bakterien, die im Wurzelgewebe von Hülsenfrüchten (z. B. Luzerne, Erbsen und Bohnen) und Hülsenfrüchten (wie Erle) leben, sowie von Cyanobakterien und Biomasse in Stickstoff umgewandelt Azotobacter (Sposito, 2011).
Durch Ammonium (NH4 +) können Wasserpflanzen Stickstoff absorbieren und in Proteine, Aminosäuren und andere Moleküle einbauen. Hohe Ammoniakkonzentrationen können das Wachstum von Algen und Wasserpflanzen erhöhen.
Ammoniumhydroxid und andere Ammoniumsalze werden häufig in der Lebensmittelverarbeitung verwendet. Gemäß den Vorschriften der Food and Drug Administration (FDA) ist Ammoniumhydroxid als Hefemittel, pH-Kontrollmittel und Veredelungsmittel sicher ("allgemein als sicher anerkannt" oder GRAS) in Lebensmitteln oberflächlich.
Die Liste der Lebensmittel, in denen Ammoniumhydroxid als direkter Lebensmittelzusatz verwendet wird, ist umfangreich und umfasst Backwaren, Käse, Pralinen, andere Süßwaren (z. B. Süßigkeiten) und Pudding. Ammoniumhydroxid wird auch als antimikrobielles Mittel in Fleischprodukten verwendet.
Ammoniak in anderen Formen (z. B. Ammoniumsulfat, Ammoniumalginat) wird in Gewürzen, Sojaproteinisolaten, Snacks, Marmeladen und Gelees sowie alkoholfreien Getränken verwendet (PNA Kaliumnitrat-Vereinigung, 2016)..
Die Ammoniummessung wird im RAMBO-Test verwendet, insbesondere zur Diagnose der Ursache der Azidose (Test-ID: RAMBO Ammonium, Random, Urine, S.F.). Die Niere reguliert die Säureausscheidung und das systemische Säure-Base-Gleichgewicht.
Das Ändern der Ammoniakmenge im Urin ist ein wichtiger Weg für die Nieren, dies zu tun. Die Messung des Ammoniakspiegels im Urin kann Aufschluss über die Ursache einer Störung des Säure-Basen-Gleichgewichts bei Patienten geben..
Der Ammoniakspiegel im Urin kann auch viele Informationen über die tägliche Säureproduktion bei einem bestimmten Patienten liefern. Da der größte Teil der Säurebelastung eines Menschen aus aufgenommenem Protein stammt, ist die Menge an Ammoniak im Urin ein guter Indikator für die Proteinaufnahme über die Nahrung.
Urin-Ammoniak-Messungen können besonders nützlich für die Diagnose und Behandlung von Patienten mit Nierensteinen sein:
- Hohe Ammoniakspiegel im Urin und ein niedriger pH-Wert im Urin deuten auf anhaltende Magen-Darm-Verluste hin. Bei diesen Patienten besteht ein Risiko für Harnsäure- und Calciumoxalatsteine..
- Ein wenig Ammoniak im Urin und ein hoher pH-Wert des Urins deuten auf eine renale tubuläre Azidose hin. Bei diesen Patienten besteht ein Risiko für Calciumphosphatsteine.
- Patienten mit Calciumoxalat- und Calciumphosphatsteinen werden häufig mit Citrat behandelt, um das Urincitrat (ein natürlicher Inhibitor des Wachstums von Calciumoxalat- und Calciumphosphatkristallen) zu erhöhen..
Da Citrat jedoch zu Bicarbonat (einer Base) metabolisiert wird, kann dieses Arzneimittel auch den pH-Wert des Urins erhöhen. Wenn der pH-Wert des Urins bei der Citratbehandlung zu hoch ist, kann das Risiko von Calciumphosphatsteinen versehentlich erhöht werden..
Die Überwachung des Urins auf Ammoniak ist eine Möglichkeit, die Citratdosis zu titrieren und dieses Problem zu vermeiden. Eine gute Anfangsdosis Citrat ist etwa die Hälfte der Ammoniumausscheidung im Urin (jeweils in mÄq)..
Die Wirkung dieser Dosis auf die Ammonium-, Citrat- und pH-Werte im Urin kann überwacht und die Citratdosis basierend auf dem Ansprechen angepasst werden. Ein Abfall des Ammoniaks im Urin sollte anzeigen, ob das aktuelle Citrat ausreicht, um der täglichen Säurebelastung des jeweiligen Patienten teilweise (aber nicht vollständig) entgegenzuwirken..
Verweise
- Datenbank, menschliches Metabolom. (2017, 2. März). Zeige Metabocard für Ammonium. Wiederhergestellt von: hmdb.ca..
- Johnston, F. J. (2014). Ammoniumsalz. von accessscience abgerufen: accessscience.com.
- Nationales Zentrum für Informationen zur Biotechnologie. (2017, 25. Februar). PubChem Compound Database; CID = 16741146. Von PubChem abgerufen.
- PNA-Kaliumnitrat-Assoziation. (2016). Nitrat (NO3-) gegen Ammonium (NH4 +). von kno3.org abgerufen.
- Royal Society of Chemistry. (2015). Ammoniumion. Von chemspider wiederhergestellt: chemspider.com.
- Sposito, G. (2011, 2. September). Boden. Aus der Enzyklopädie britannica wiederhergestellt: britannica.com.
- Test ID: RAMBO Ammonium, Random, Urin. (S.F.). Von encyclopediamayomedicallaboratorie.com wiederhergestellt.
- VIAS-Enzyklopädie. (2004, 22. Dezember). Ammoniumsalze. Aus der Enzyklopädie vias.org wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.