
Physikalische und chemische Eigenschaften, Struktur, Verwendung, Toxizität von Hexan (C6H14)
Das Hexan ist ein Kohlenwasserstoff, der dadurch gekennzeichnet ist, dass er eine organische Verbindung ist, deren kondensierte chemische Formel C ist6H.14. Es ist eine farblose, transparente Flüssigkeit, die nicht mit Wasser gemischt werden kann. Es hat fünf Isomere, wobei das lineare eines der wichtigsten paraffinen Kohlenwasserstoffe in Industrie und Forschung ist.
Hexan wird durch fraktionierte Destillation von Rohöl erhalten. Ebenso ist es natürlich in Zitrusfrüchten und in flüchtigen Fraktionen verschiedener Pflanzen oder Früchte wie Apfel, Guave, gerösteten Haselnüssen, Süßkartoffeln und Salbei enthalten..
Es ist eine leicht entzündliche flüchtige Flüssigkeit, die in Benzin, schnell trocknenden Klebstoffen und Gummizement enthalten ist. Hexan wird als Lösungsmittel bei der Extraktion von Pflanzenölen sowie von Lipiden und Fetten verwendet, die in kontaminiertem Wasser und Boden vorhanden sind.
Menschen, die professionell Hexan ausgesetzt sind, können Schäden am peripheren Nervensystem erleiden, die sich in Kribbeln und Krämpfen in Beinen und Armen äußern. zusätzlich zu generalisierter Muskelschwäche und in schweren Fällen Skelettmuskelatrophie.
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften von Hexanen
- 1.1 Aussehen
- 1,2 Molmasse
- 1.3 Geruch
- 1.4 Geruchsschwelle
- 1,5 Dichte
- 1.6 Schmelzpunkt
- 1.7 Siedepunkt
- 1.8 Flammpunkt
- 1.9 Löslichkeit in Wasser
- 1.10 Löslichkeit in Lösungsmitteln
- 1.11 Relative Dampfdichte mit Luft
- 1,12 Octanol / Wasser-Verteilungskoeffizient
- 1.13 Dampfdruck
- 1.14 Wellenlänge der maximalen optischen Dichte
- 1.15 Brechungsindex
- 1.16 Viskosität
- 1.17 Kalorienkapazität
- 1.18 Verbrennungswärme
- 1.19 Verdampfungswärme
- 1.20 Oberflächenspannung
- 1.21 Ionisationspotential
- 1.22 Stabilität
- 1.23 Reaktivität
- 2 Struktur von Hexan
- 2.1 Intermolekulare Wechselwirkungen
- 2.2 Isomere
- 3 Verwendungen
- 4 Toxizität
- 4.1 Einatmen und Kontakt
- 4.2 Sichere Dosis
- 5 Referenzen
Physikalische und chemische Eigenschaften von Hexanen
Aussehen
Farblose, transparente und leicht flüchtige Flüssigkeit.
Molmasse
86,178 g / mol
Geruch
Ähnlich wie Benzin
Geruchsschwelle
1,5 ppm
Dichte
0,6606 g / ml
Schmelzpunkt
-96 bis -94 ºC
Siedepunkt
68,5 bis 69,1 ºC
Zündpunkt
-22 ºC (geschlossene Tasse).
Wasserlöslichkeit
9,5 mg / l (praktisch nicht mit Wasser mischbar)
Löslichkeit in Lösungsmitteln
Sehr gut löslich in Ethanol, löslich in Ethylether und Chloroform. Mit Alkohol, Chloroform und Ether mischbar.
Relative Dampfdichte mit Luft
2,97 (Luft = 1)
Octanol / Wasser-Verteilungskoeffizient
Log P = 3,764
Dampfdruck
17,60 kPa bei 20 ºC
Wellenlänge der maximalen optischen Dichte
200 nm
Brechungsindex
1,375
Viskosität
0,3 mPa s
Kalorienkapazität
265,2 JK-1Maulwurf-1
Verbrennungswärme
4,163,2 kJ mol-1
Verdampfungswärme
31,56 kJ mol-1
Oberflächenspannung
17,89 mN / m bei 25 ºC
Ionisationspotential
10.18 eV
Stabilität
Stabil. Unverträglich mit Oxidationsmitteln, Chlor, Fluor, Magnesiumperchlorat. Bildet mit Luft ein explosives Gemisch.
Reaktivität
Hexan kann heftig mit oxidierenden Materialien reagieren, zu denen flüssiges Chlor, konzentrierter Sauerstoff, Natriumhypochlorit und Calciumhypochlorit gehören können. Es ist auch nicht kompatibel mit Distickstofftetroxid. Hexan kann einige Formen von Kunststoffen, Gummi und Beschichtungen angreifen.
Struktur von Hexan
Intermolekulare Wechselwirkungen
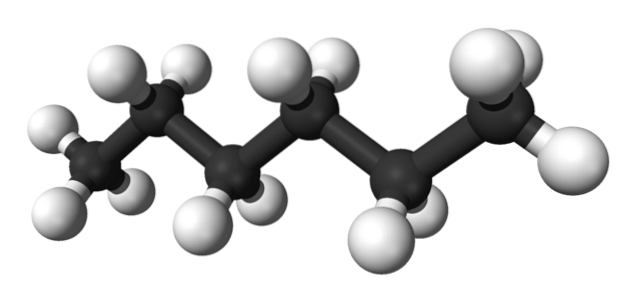
Das erste Bild zeigt das Molekül von n-Hexan, dargestellt durch ein Ball-and-Stick-Modell. Die schwarzen Kugeln entsprechen den Kohlenstoffatomen und bilden das zickzackförmige Kohlenstoffgerüst, während die weißen Kugeln die Wasserstoffatome sind. Das n-Hexan ist daher ein Kohlenwasserstoff, linear und hochdynamisch.
Da alle seine CH-Bindungen eine niedrige Polarität haben, fehlt dem Molekül ein Dipolmoment. Dabei sind ihre intermolekularen Wechselwirkungen nicht vom Dipol-Dipol-Typ, sondern hängen ausschließlich von der Molekülmasse und den Dispersionskräften Londons ab..
Jedes Molekül von n-Hexan "passt" bei sehr niedrigen Temperaturen übereinander, wie in seiner Kristallstruktur angenommen werden würde. Andererseits biegen und drehen sich in der Flüssigkeit ihre Skelette und drehen ihre CH-Bindungen, wodurch die Flüssigkeit flüchtig wird und bei 68,7 ºC siedet..
Isomere
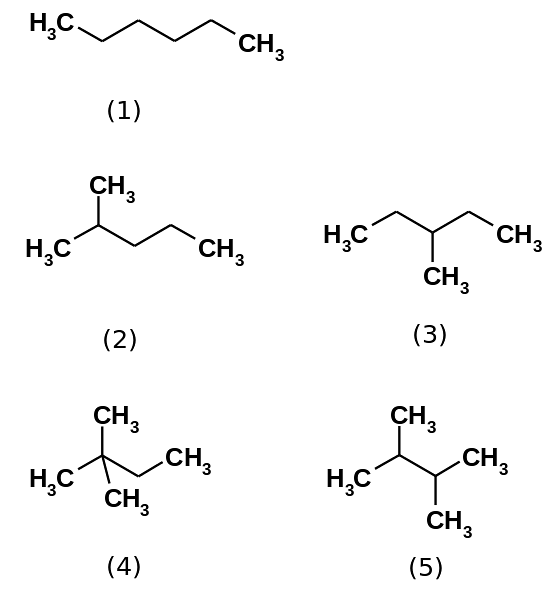
Der Kohlenwasserstoff Hexan besteht tatsächlich aus fünf Isomeren, nämlich dem n-Hexan am wenigsten verzweigt, (1). Die anderen vier Isomere sind in aufsteigender Reihenfolge:
2-Methylpropan (2)
3-Methylpropan (3)
2,2-Dimethylbutan (4)
2,3-Dimethylbutan (5)
Beachten Sie auch, dass die Strukturen von (1) nach (5) stärker verzweigt werden. Wenn sie stärker verzweigt sind, nehmen die Dispersionskräfte ab, da es keine linearen Abschnitte mehr gibt, die effizient keilen. Dies führt zu einer Abnahme und Variation der Siedepunkte der Isomere; obwohl einige akzeptable Abweichungen beobachtet werden.
Sowohl 2-Methylpropan (bp = 60,3 ° C) als auch 3-Methylpropan (bp = 63,3 ° C) sind gleich verzweigt, aber ihre Siedepunkte sind unterschiedlich. Anschließend folgt 2,3-Dimethylbutan (peb = 58 ºC), um schließlich 2,2-Dimethylbutan als flüchtigste Flüssigkeit zu lokalisieren (peb = 49,7 ºC)..
Anwendungen
Hexan wird mit ähnlichen Chemikalien gemischt, um Lösungsmittel herzustellen. Unter den Namen, die diesen Lösungsmitteln gegeben werden, sind handelsübliches Hexan, gemischte Hexane usw. Sie werden als Reinigungsmittel in der Textil-, Möbel- und Tiefdruckindustrie eingesetzt..
Hexan ist ein Bestandteil von Klebstoffen, die in Dachabdichtungen, Schuhen und Leder verwendet werden. Es wird auch zum Binden von Büchern, zum Formen von Pillen und Tabletten, zum Einmachen, zum Herstellen von Reifen und Baseball verwendet..
Hexan wird zur Bestimmung des Brechungsindex von Mineralien und Füllflüssigkeit für Thermometer anstelle von Quecksilber verwendet. normalerweise mit einer roten oder blauen Tönung. Es wird auch bei der Extraktion von Fett und Öl aus Wasser zur Analyse seiner Verunreinigungen verwendet..
Hexan wird als Lösungsmittel bei der Extraktion von Öl aus Gemüsesamen wie Sojabohnen, Raps oder Brombeeren verwendet. Darüber hinaus werden damit Teile unterschiedlicher Herkunft entfettet. Es wird bei der Denaturierung von Alkohol, bei der HPLC-Analyse und bei der Spektrophotometrie verwendet.
Toxizität
Einatmen und Kontakt
Die akute Toxizität von Hexan ist relativ gering, obwohl es sich um ein mildes Anästhetikum handelt. Akute Exposition gegenüber hohen Hexankonzentrationen kann beim Einatmen zu einer leichten Depression des Zentralnervensystems (ZNS) führen, die sich in Schwindel, Schwindel, leichter Übelkeit und Kopfschmerzen äußert..
Es kann auch Dermatitis und Reizungen der Augen und des Rachens verursachen. Das chronische Einatmen von Hexan im Zusammenhang mit der Arbeitsaktivität kann das periphere Nervensystem schädigen (sensomotorische Polyneuropathie)..
Erste Symptome sind Kribbeln und Krämpfe in Beinen und Armen, gefolgt von Muskelschwäche. In schweren Fällen kann es zu einer Skelettmuskelatrophie sowie zu Koordinationsverlust und Sehstörungen kommen.
Die Hexantoxizität hängt mit der Bildung des Hexan-2,5-dion-Metaboliten zusammen. Es reagiert mit der Aminosäure Lysin einer Proteinseitenkette und verursacht den Verlust der Proteinfunktion..
Sichere Dosis
Die Enviromental Protection Agency (EPA) berechnete eine Referenzkonzentration (RfC) für Hexan von 0,2 mg / m3, und eine Referenzdosis (RfD) von 0,06 mg / kg Körpergewicht / Tag.
In den 1960er und 1970er Jahren hatte eine Gruppe von Arbeitern in der Schuhindustrie in Japan nervöse Störungen. Die Ursache war, dass sie 8 bis 14 Stunden pro Tag in einer Hexanatmosphäre von 500 bis 2.500 ppm atmeten.
Die Arbeiter zeigten die bekannten Symptome einer chronischen Inhalation von Hexan und stellten bei den Ärzten fest, dass die Nerven, die die Muskeln der Arme und Beine kontrollierten, beschädigt waren..
Verweise
- Danielle Reid. (2019). Hexan: Struktur, Formel & Eigenschaften. Studie. Wiederhergestellt von: study.com
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Hexan. PubChem-Datenbank. CID = 8058. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Hexan. Wiederhergestellt von: en.wikipedia.org
- Welt der Moleküle. (s.f.). Hexanmolekül. Wiederhergestellt von: worldofmolecules.com
- Chemisches Buch. (2017). Hexan. Wiederhergestellt von: Chemicalbook.com
- Commonwealth of Australia. (s.f.). n-Hexan: Emissionsquellen. Wiederhergestellt von: npi.gov.au.
- EPA. (2000). Hexan. [PDF]. Wiederhergestellt von: epa.gov
- Agentur für Giftstoffe und Krankheitsregister. (1999). Erklärung zur öffentlichen Gesundheit von n-Hexan. Wiederhergestellt von: atsdr.cdc.gov


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.