
Inkretin-Typen und ihre Struktur, Funktionen, Wirkmechanismus
Das Inkretin sind gastrointestinale Hormone, die die Sekretion physiologischer Insulinkonzentrationen stimulieren. Der Begriff wird derzeit verwendet, um zwei verschiedene Darmhormone zu bezeichnen, die unterschiedliche technische Namen haben: GIP oder "Glukose-abhängiges insulinotropes Polypeptid" und GLP-1 oder "Glukagon-ähnliches Peptid 1"..
"Incretin" ist ein Wort und ein Konzept, das 1932 vom belgischen Physiologen Jean La Barre geprägt wurde. Er führte es ein, um die intestinalen hormonellen Faktoren zu definieren, die die Wirkung von Sekretin auf die endokrine Pankreassekretion ergänzten..
Mit anderen Worten, La Barre verwendete den Begriff Inkretin, um jedes Darmhormon zu bezeichnen, das unter physiologischen Bedingungen die Sekretion von Pankreashormonen wie Insulin, Glucagon, Pankreas-Polypeptid (PP) und Somatostatin stimulieren oder dazu beitragen konnte.
Gegenwärtig wird der Begriff "Inkretin" jedoch nur verwendet, um jene Hormone zu bezeichnen, die die Glukose-abhängige Pankreasinsulinsynthese stimulieren können, insbesondere zwei Peptide, die als GIP und GLP-1 bekannt sind. Das Aufkommen neuer Technologien und tiefer gehender endokrinologischer Studien könnte jedoch viele andere Peptide mit ähnlichen Aktivitäten aufdecken..
Artikelverzeichnis
- 1 Arten von Inkretinen und ihre Struktur
- 2 Funktionen
- 3 Wirkmechanismus
- 3.1 GIP: Glukoseabhängiges insulinotropes Polypeptid
- 3.2 GLP-1: Glucagon-ähnliches Peptid 1
- 4 Referenzen
Arten von Inkretinen und ihre Struktur
Traditionell wurden beim Menschen nur zwei Inkretine definiert: Glukose-abhängiges insulinotropes Polypeptid (GIP) und Glukagon-ähnliches Peptid 1 (GLP-1); Die beiden Hormone stimulieren additiv die Insulinsekretion.
Das erste davon, das isoliert wurde, war das Glucose-abhängige insulinotrope Polypeptid (GIP). Glukoseabhängiges insulinotropes Polypeptid). Es ist ein Peptidhormon mit etwa 42 Aminosäuren und gehört zur Familie der Glucagon-Sekretin-Peptide.

Das zweite entdeckte Inkretin war das Glucagon-ähnliche Peptid 1 (GLP-1). Glucagon-ähnliches Peptid-1), das ein Nebenprodukt des Gens ist, das für das Hormon "Proglucagon" kodiert; Teil des C-terminalen Endes des Proteins, um genau zu sein.
Eigenschaften
Anfänglich wurden Inkretine als Faktoren definiert, die aus dem Darmtrakt stammen und die Plasmaglucosespiegel durch Stimulierung der Sekretion von Pankreashormonen wie Insulin und Glucagon senken können..
Dieses Konzept wurde mit dem Aufkommen von Radioimmunoassays beibehalten, bei denen eine dauerhafte Kommunikation zwischen dem Darm und der endokrinen Bauchspeicheldrüse bestätigt wurde..
Es wurde gezeigt, dass die orale Verabreichung von Glucose mit einem signifikanten Anstieg der Plasma-Insulinspiegel verbunden ist, insbesondere im Vergleich zu Ergebnissen, die mit intravenöser Glucose erhalten wurden..
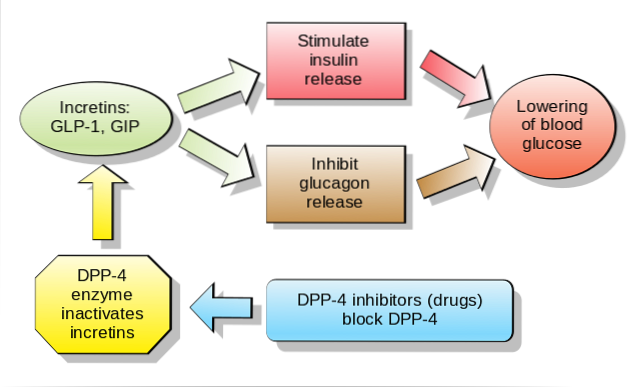
Es wird angenommen, dass Inkretine für die Sekretion von fast 70% des Plasmainsulins nach oraler Glukoseverabreichung verantwortlich sind, da es sich um Hormone handelt, die als Reaktion auf die Nährstoffaufnahme sekretiert werden und die Sekretion von Glukose-Insulin-abhängig verstärken.
Derzeit werden viele Anstrengungen hinsichtlich der oralen oder intravenösen Verabreichung von Inkretinen an Patienten mit Krankheiten wie Typ-2-Diabetes mellitus oder oraler Glukoseintoleranz unternommen. Dies liegt daran, dass Studien, wenn auch vorläufig, gezeigt haben, dass diese Substanzen die rasche Abnahme der glykämischen Spiegel nach der Nahrungsaufnahme erleichtern..
Wirkmechanismus
GIP: Glukoseabhängiges insulinotropes Polypeptid
Dieses Inkretin wird von den K-Zellen des Dünndarms (insbesondere im Zwölffingerdarm und Jejunum) als Reaktion auf die Aufnahme von Fett oder Glukose produziert und ist für die Erhöhung der durch Glukose stimulierten Insulinsekretion verantwortlich.
Die Expression des Gens, das für diesen hormonellen Faktor kodiert, wurde bei Menschen und Nagetieren sowohl im Magen als auch im Darm nachgewiesen. Mit diesem Hormon durchgeführte Studien zeigen, dass es von einem "proGIP" -Vorläufer mit 153 Aminosäuren stammt, der an seinen N- und C-terminalen Enden zwei Signalpeptide aufweist, die gespalten werden, um ein aktives Peptid mit 42 Resten zu ergeben..
Die Halbwertszeit von GIP beträgt weniger als 7 Minuten, sobald es synthetisiert und enzymatisch verarbeitet wurde. Dieses Peptid wird von einem spezifischen Rezeptor erkannt, dem GIPR, der sich in der Plasmamembran der Zellen der Bauchspeicheldrüse, im Magen, im Dünndarm, im Fettgewebe, in der Nebennierenrinde, in der Hypophyse befindet das Herz, die Lunge und andere wichtige Organe.
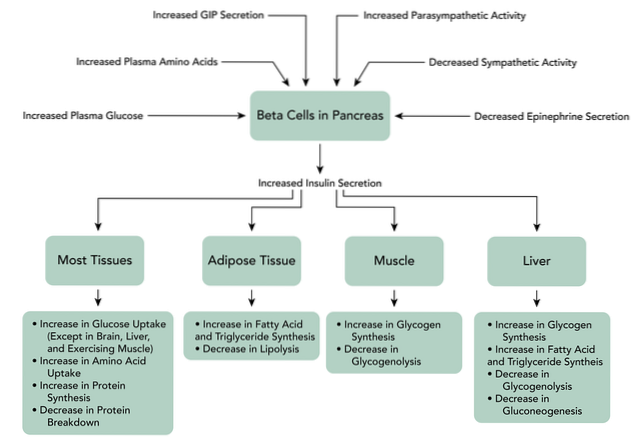
Wenn GIP an seine Rezeptoren auf den Beta-Zellen der Bauchspeicheldrüse bindet, löst es eine Erhöhung der Produktion von cAMP aus, auch die Hemmung von ATP-abhängigen Kaliumkanälen, die Erhöhung des intrazellulären Kalziums und schließlich die Exozytose des Insulinspeichergranulats.
Darüber hinaus kann dieses Peptid die Gentranskription und Insulinbiosynthese sowie die anderen Komponenten von Betazellen der Bauchspeicheldrüse stimulieren, um Glukose zu "zensieren". Obwohl GIP hauptsächlich als Inkretinhormon wirkt, übt es auch andere Funktionen in anderen Geweben aus, wie z. B. im Zentralnervensystem, unter anderem in Knochen..
GLP-1: Glucagon-ähnliches Peptid 1
Dieses Peptid wird aus dem Gen hergestellt, das für "Proglucagon" kodiert. Es handelt sich also um ein Peptid, das nahezu 50% Identität mit der Glucagonsequenz aufweist und daher als "Glucagon-ähnliches" Peptid bezeichnet wird.
GLP-1, ein posttranslationales proteolytisches Produkt, ist gewebespezifisch und wird von den L-Zellen des Darms als Reaktion auf die Nahrungsaufnahme produziert. Wie GIP hat dieses Inkretin die Fähigkeit, die durch Glukose stimulierte Insulinsekretion zu erhöhen.
Genexpression und -verarbeitung
Dieses Peptid ist in einem der Exons des Proglucagon-Gens kodiert, das in den Alpha-Zellen der Bauchspeicheldrüse, in den L-Zellen des Darms (im distalen Ileum) und in Neuronen des Hirnstamms und des Hypothalamus exprimiert wird.
In der Bauchspeicheldrüse wird die Expression dieses Gens durch Fasten und Hypoglykämie (niedrige Glukosekonzentrationen im Blut) stimuliert und durch Insulin gehemmt. In Darmzellen wird die Expression des Gens für Proglucagon durch erhöhte cAMP- und Nahrungsaufnahme aktiviert.
Das Produkt, das aus der Expression dieses Gens resultiert, wird in den enteroendokrinen L-Zellen (im Dünndarm) posttranslational verarbeitet, was nicht nur zur Freisetzung von Glucagon-ähnlichem Peptid 1 führt, sondern auch zu anderen etwas unbekannten Faktoren wie Glicentin, Oxyintomodulin, Glucagon-ähnliches Peptid 2 usw..
Produktion und Aktion
Die Aufnahme von Nahrungsmitteln, insbesondere solchen, die reich an Fetten und Kohlenhydraten sind, stimuliert die Sekretion des GLP-1-Peptids aus enteroendokrinen L-Zellen des Darms (Nervenstimulation oder Stimulation, die durch viele andere Faktoren vermittelt wird, kann ebenfalls auftreten)..
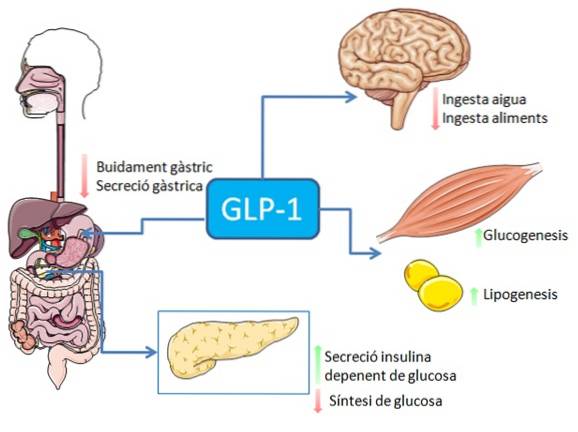
Bei Menschen und Nagetieren wird dieses Peptid in zwei Phasen in den Blutkreislauf freigesetzt: 10-15 Minuten nach der Einnahme und 30-60 Minuten später. Die aktive Lebensdauer dieses Hormons im Blut beträgt weniger als 2 Minuten, da es durch das Enzym Dipeptidylpeptidase-4 (DPP-4) schnell proteolytisch inaktiviert wird..
GLP-1 bindet an einen spezifischen Membranrezeptor (GLP-1R) an verschiedenen Zellen im Körper, einschließlich einiger endokriner Zellen der Bauchspeicheldrüse, wo es die glukoseabhängige Insulinsekretion stimuliert.
Wie?
Die Bindung von GLP-1 an seinen Rezeptor an Beta-Zellen der Bauchspeicheldrüse aktiviert die Produktion von cAMP, das durch Adenylatcyclase in diesen Zellen vermittelt wird. Es gibt eine direkte Hemmung von ATP-abhängigen Kaliumkanälen, die die Zellmembran depolarisieren.
Anschließend steigen die intrazellulären Calciumspiegel an, was das Ergebnis des GLP-1-abhängigen Zuflusses von extrazellulärem Calcium durch spannungsabhängige Calciumkanäle, der Aktivierung nichtselektiver Kationenkanäle und der Mobilisierung von Calciumreserven intrazellulär ist.
Es erhöht auch die mitochondriale ATP-Synthese, was die Depolarisation begünstigt. Später werden die spannungsgesteuerten Kaliumkanäle geschlossen, wodurch die Repolarisation der Beta-Zellen verhindert wird und schließlich eine Exozytose des Insulinspeichergranulats auftritt..
Im Magen-Darm-System hat die Bindung von GLP-1 an seine Rezeptoren eine hemmende Wirkung auf die Magensäuresekretion und die Magenentleerung, wodurch der mit der Nahrungsaufnahme verbundene Anstieg des Blutzuckerspiegels abgeschwächt wird..
Verweise
- Baggio, L. L. & Drucker, D. J. (2007). Biologie der Inkretine: GLP-1 und GIP. Gastroenterology, 132 (6), 2131 & ndash; 2157.
- Deacon, C. F. & Ahrén, B. (2011). Physiologie von Inkretinen in Gesundheit und Krankheit. Die Überprüfung der Diabetes-Studien: RDS, 8 (3), 293.
- Grossman, S. (2009). Differenzierung von Inkretintherapien anhand von Strukturaktivität und Stoffwechsel: Fokus auf Liraglutid. Pharmakotherapie: The Journal of Human Pharmacology and Drug Therapy, 29 (12P2), 25S-32S.
- Kim, W. & Egan, J. M. (2008). Die Rolle von Inkretinen bei der Glukosehomöostase und der Behandlung von Diabetes. Pharmacological Reviews, 60 (4), 470-512.
- M. A. Nauck & J. J. Meier (2018). Inkretinhormone: ihre Rolle für Gesundheit und Krankheit. Diabetes, Fettleibigkeit und Stoffwechsel, 20, 5-21.
- Rehfeld, J. F. (2018). Der Ursprung und das Verständnis des Inkretin-Konzepts. Grenzen in der Endokrinologie, 9.
- Vilsbøll, T. & Holst, J. J. (2004). Inkretine, Insulinsekretion und Typ-2-Diabetes mellitus. Diabetologia, 47 (3), 357 & ndash; 366



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.