
Natriumhydroxid (NaOH) Struktur, Eigenschaften, Verwendungen, Synthese

Das Natriumhydroxid Es ist eine anorganische Verbindung, deren chemische Formel NaOH ist und aus einer sehr starken metallischen Base oder Alkali besteht. Eine 5% ige Lösung davon in Wasser hat einen pH-Wert nahe 14.
Es ist ein sehr hygroskopischer weißer Feststoff, der auch Kohlendioxid aus der Luft absorbieren kann, um Natriumcarbonat zu bilden. Es kommt im Handel in Plastikflaschen als Pillen, die nicht zu lange der Luft ausgesetzt werden dürfen, noch sollten sie mit Spateln manipuliert werden.

Natriumhydroxid kann durch Umsetzung von Calciumhydroxid mit Natriumcarbonat synthetisiert werden. Derzeit wird es jedoch grundsätzlich durch Elektrolyse von Salzlösung synthetisiert und ist ein Nebenprodukt bei der Herstellung von Chlorgas.
Aufgrund der hohen Basizität von NaOH hat es zahlreiche Verwendungszwecke und Anwendungen, wie die Herstellung von Papier, Seifen, Waschmitteln, Farbstoffen usw. Es wird auch in der Haushaltsreinigung, Wasseraufbereitung, Aluminiumverarbeitung, Herstellung von Arzneimitteln usw. Verwendet. und vor allem ist es ein sekundäres Muster schlechthin.
Natriumhydroxid ist sehr ätzend und kann Reizungen und Verbrennungen an Haut und Augen verursachen. Durch Einatmen des Staubes kann es zu Lungenödemen kommen. In der Zwischenzeit kann seine Einnahme den Verdauungstrakt so stark schädigen, dass er zum Tod führen kann..
Artikelverzeichnis
- 1 Struktur
- 1.1 Wasserfrei
- 1.2 Hydrate
- 2 Physikalische und chemische Eigenschaften
- 2.1 Namen
- 2,2 Molmasse
- 2.3 Aussehen
- 2.4 Schmelzpunkt
- 2,5 Siedepunkt
- 2.6 Löslichkeit in Wasser
- 2.7 Basizität (pKb)
- 2,8 pH
- 2.9 Brechungsindex (nD)
- 2.10 Stabilität
- 2.11 Zersetzung
- 2.12 Selbstentzündungspunkt
- 2.13 Viskosität
- 2.14 Verdampfungswärme
- 2.15 Oberflächenspannung
- 2.16 Reaktivität
- 3 Synthese
- 3.1 Reaktion von Natriumcarbonat und Calciumhydroxid
- 3.2 Elektrolyse von Natriumchlorid
- 4 Verwendungen
- 4.1 Reinigungsprodukte
- 4.2 Pharmazeutische und medizinische Produkte
- 4.3 Energieprozesse
- 4.4 Wasseraufbereitung
- 4.5 Papierherstellung
- 4.6 Industrielle Fertigung
- 5 Risiken
- 6 Referenzen
Struktur
Wasserfrei

Das obere Bild zeigt die Ionen, aus denen NaOH besteht. Das Na-Kation+ wird durch die violette Kugel dargestellt, während das Hydroxylanion (Hydroxid oder Hydroxyl) OH- durch die rot-weiße Kugel. Beide Na-Ionen+ und OH- interagieren miteinander durch die elektrostatische Anziehung ihrer entgegengesetzten Ladungen.
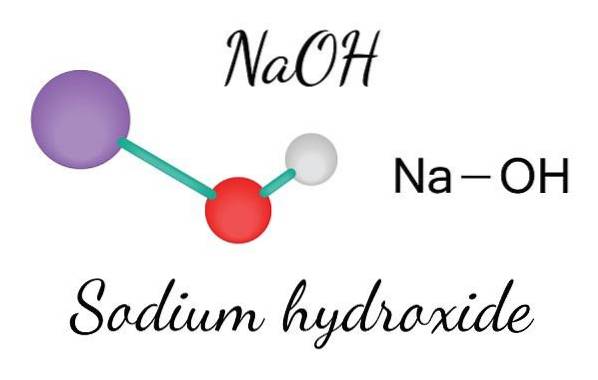
Solche Wechselwirkungen sind ungerichtet, also die Anziehungskräfte eines Ionenpaars Na+Oh- es kann die von anderen in einer bestimmten Entfernung beeinflussen. Das Ergebnis ist, dass die Na-Ionen+ sich gegenseitig abstoßen, genauso wie OH-, bis sie einen Kristall mit minimaler Energie definieren, wo sie eine geordnete und periodische Struktur (kristallin) herstellen.
Daher erscheinen die orthorhombischen Kristalle von wasserfreiem NaOH (ohne Wasser):
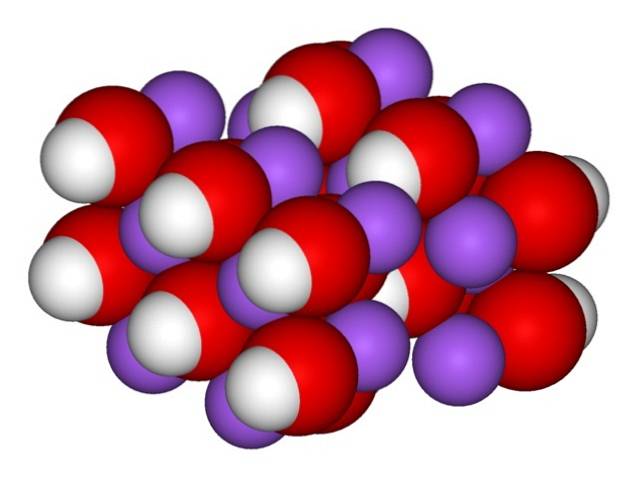
Die Ionen bleiben ausreichend kohäsiv, so dass der wasserfreie NaOH-Kristall bei 323 ºC schmilzt (solange keine Feuchtigkeit in der Umgebung vorhanden ist)..
Hydrate
Sowohl die Na+ wie OH- Es sind Ionen, die Wassermoleküle leicht solvatisieren (hydratisieren). Dies begünstigt seine Hydratation über der retikulären Energie seiner Kristalle, weshalb NaOH viel Energie freisetzt, wenn es mit Wasser in Kontakt kommt..
Wasserfreie Kristalle können jedoch ungelöste Wassermoleküle enthalten; Das heißt, Natriumhydroxid kann zahlreiche Hydrate bilden, NaOH nHzweiO. Das Wassermolekül kann durchaus eine Wasserstoffbrücke mit dem OH bilden- (HOH-OH-) oder koordinieren mit dem Na+ (N / A+-Ohzwei).
Abhängig vom Molverhältnis zwischen NaOH und H.zweiOder Monohydrate (NaOHHzweiO), Dihydrate (NaOH 2HzweiO), Trihemidrate (NaOH 3,5HzweiO), Tetrahydrate (NaOH 4HzweiO), Heptahydrate (NaOH 7HzweiO) und mehr.
Jedes dieser Hydrate kann aus einer wässrigen Lösung von NaOH mit unterschiedlichen Massenprozentsätzen und bei unterschiedlichen Temperaturen kristallisieren. Folglich zeigt NaOH ein kompliziertes Wasserlöslichkeitsdiagramm..
Im Allgemeinen sind die Hydratkristalle weniger dicht und haben niedrigere Schmelzpunkte. Dies liegt daran, dass die Wassermoleküle die Wechselwirkungen zwischen Na „behindern“+ und OH-, Hinzufügen von Dipol-Dipol-Kräften beim Opfer ionischer Anziehungskräfte.
Physikalische und chemische Eigenschaften
Namen
IUPAC bevorzugter Name: Natriumhydroxid. Andere Namen: Ätznatron, Ascarit (seltener)
Molmasse
39,9971 g / mol
Aussehen
Weißer, seröser oder undurchsichtiger Feststoff oder Kristalle.
Schmelzpunkt
323 ºC
Siedepunkt
1.388 ºC
Wasserlöslichkeit
1.000 g / l bei einer Temperatur von 25 ° C. Dies zeigt, wie viel es sich in Wasser lösen kann..
Ihre wässrigen Lösungen sind viskos mit einem Viskositätswert, der etwa achtzigmal so hoch ist wie der von Wasser, und sie geben zunächst viel Wärme ab. Wenn Sie Kontakt mit ihnen haben, machen sie die Haut aufgrund der Verseifung der Fettsäuren in der Haut rutschig..
Basizität (pKb)
- 0,56
pH
Eine 5% w / w-Lösung in Wasser hat einen pH-Wert nahe 14
Brechungsindex (nD)
Bei einer Wellenlänge von 580,4 nm: 1.433 bei 320 ºC und 1.421 bei 420 ºC.
Stabilität
Behälter, die es enthalten, müssen hermetisch verschlossen sein, um die Bildung von Natriumcarbonat zu verhindern. Dies ist auf seine hohe Hygroskopizität zurückzuführen, die dazu führt, dass es Feuchtigkeit aus seiner Umgebung und seinen CO-Gehalt aufnimmt.zwei.
Zersetzung
Beim Erhitzen zur Zersetzung entsteht Natriumoxidrauch.
Selbstentzündungspunkt
Es ist nicht brennbar
Viskosität
4,0 cPoise bei 350 ºC
Verdampfungswärme
175 kJ / mol bei 1.388 ºC
Oberflächenspannung
74,35 Dyn / cm in einer 2,72% w / w-Lösung in Wasser bei 18 ° C..
Reaktivität
Mit Säuren
Reagiert mit organischen und anorganischen Mineralsäuren unter Bildung von Wasser und dem entsprechenden Salz. Im Fall von Schwefelsäure ist die Reaktion exotherm.
2 NaOH + H.zweiSW4 => NazweiSW4 + 2 hzweiODER
Mit sauren Oxiden
Reagiert zum Beispiel mit Schwefeldioxid und ergibt ein Sulfitsalz von und Wasser:
2 NaOH + SOzwei => NazweiSW3 + H.zweiODER
Mit Metallen
Seine wässrigen Lösungen reagieren mit einigen Metallen unter Bildung komplexer Natriumsalze. Beispielsweise führt seine Reaktion mit Zink zu einem Natriumzinkat:
Zn + 2 NaOH + 2 H.zweiO => Nazwei[Zn (OH)4] + H.zwei
Synthese
Natriumhydroxid wird hauptsächlich nach zwei Methoden synthetisiert: der Verwendung von ursprünglich verwendetem Natriumcarbonat und der Elektrolyse von Natriumchlorid, das derzeit in größerem industriellen Einsatz ist..
Reaktion von Natriumcarbonat und Calciumhydroxid
Natriumcarbonat reagiert mit Calciumhydroxid in einem Prozess, der als Ätzung bekannt ist:
Ca (OH)zwei + N / AzweiCO3 => CaCO3 + NaOH
Calciumcarbonat fällt aus und hinterlässt Natriumhydroxid im Überstand, der durch Verdampfung konzentriert wird.
Natriumcarbonat stammt zuvor aus dem Solvay-Verfahren:
2 NaCl + CaCO3 => NazweiCO3 + CaClzwei
Elektrolyse von Natriumchlorid
Die Elektrolyse von Natriumchlorid, das in der Salzlösung vorhanden ist, erzeugt Wasserstoffgas, Chloridgas und Natriumhydroxid in wässriger Lösung:
2 Nacl + 2 H.zweiO => H.zwei + Clzwei + 2 NaOH
Die Elektrolytkammer besteht aus einem Fach, in dem sich die Anode (+) aus Titanmetall befindet, und einem Ort, in dem sich die Sole befindet. Dieses Fach ist durch eine poröse Membran vom Kathodenfach (-) getrennt..
Die folgende Reaktion findet an der Anode statt:
2 Cl- => Clzwei + 2 e- (Oxidation)
Währenddessen findet diese Reaktion an der Kathode statt:
2 hzweiO + 2 e- => H.zwei + Oh- (die Ermäßigung)
Natrium (Na+) diffundiert vom Anodenraum zum Kathodenraum durch die Membran, die sie trennt, und bildet Natriumhydroxid.
Anwendungen
Reinigungsmittel
Natriumhydroxid wird zur Herstellung von Seifen und Reinigungsmitteln verwendet, die zu Hause und in der Wirtschaft verwendet werden. Die Kombination von Natriumhydroxid und Chlor erzeugt Chlorbleiche, die zum Waschen weißer Kleidung verwendet wird.
Es beseitigt auch die Ansammlung von Fett in den Abflüssen und bewirkt seine Beseitigung durch die Umwandlung in Seifen durch den Verseifungsprozess. Dies ermöglicht die Beseitigung der Verstopfung der Rohre der Häuser und anderer Gebäude.
Pharmazeutische und medizinische Produkte
Natriumhydroxid wird verwendet, um übliche Schmerzmittel wie Aspirin herzustellen. Auch von Arzneimitteln mit gerinnungshemmender Wirkung, die die Bildung von Blutgerinnseln blockieren, und von Arzneimitteln zur Verringerung der Hypercholesterinämie.
Energieprozesse
Natriumhydroxid wird bei der Herstellung von Brennstoffzellen verwendet, die wie Batterien funktionieren, um Strom für eine Vielzahl von Anwendungen, einschließlich des Transports, zu erzeugen. Epoxidharze, die unter Einbeziehung von Natriumhydroxid hergestellt werden, werden in Windkraftanlagen verwendet.
Wasserversorgung
Natriumhydroxid wird verwendet, um den Säuregehalt des Wassers zu neutralisieren und zur Entfernung von Schwermetallen beizutragen. Es wird auch zur Herstellung von Natriumhypochlorit, einem Wasserdesinfektionsmittel, verwendet.
Natriumhydroxid wird mit Aluminiumsulfat zu Aluminiumhydroxid umgesetzt: einem Flockungsmittel, das in Wasseraufbereitungsanlagen verwendet wird, um die Sedimentation von Partikeln zu erhöhen und deren Klärung zu bewirken..
Papierherstellung
Natriumhydroxid wird zusammen mit Natriumsulfid bei der Behandlung von Holz verwendet, um Cellulose in nahezu reiner Form zu erhalten, die die Basis für Papier bildet. Es wird auch beim Recycling von Papier verwendet, da es durch die Trennung der Tinte wieder verwendet werden kann.
Industrielle Fertigung
Natriumhydroxid wird zur Herstellung von Rayon, Spandex, Sprengstoffen, Epoxidharzen, Glas und Keramik verwendet. Es wird in der Textilindustrie zur Herstellung von Farbstoffen und zur Verarbeitung von Baumwollgeweben verwendet.
In Zuckerrohrbehandlungsanlagen wird Natriumhydroxid bei niedriger Temperatur zur Herstellung von Ethanol aus Zuckerrohrbagasse verwendet.
Risiken
Natriumhydroxid ist eine stark ätzende Verbindung und kann durch Hautkontakt Verbrennungen, Blasen und sogar bleibende Narben verursachen.
Bei Kontakt mit den Augen kann es zu schweren Verbrennungen, Schwellungen, Schmerzen, Sehstörungen und in schweren Fällen zu dauerhafter Blindheit kommen..
Das Verschlucken von Natriumhydroxid kann zu Verbrennungen an Lippen, Zunge, Hals, Speiseröhre und Magen führen. Häufige Symptome sind Übelkeit, Erbrechen, Magenkrämpfe und Durchfall..
Obwohl das Einatmen von Natriumhydroxid selten ist und nur aufgrund des Vorhandenseins von Staub der Verbindung in der Luft oder aufgrund der Bildung eines Nebels, der es enthält, auftreten kann, führt es zu Reizungen in der Lunge..
Bei chronischer Exposition kann dies zu Lungenödemen und schwerer Atemnot führen, was einen medizinischen Notfall darstellt..
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Natriumhydroxid. Wiederhergestellt von: en.wikipedia.org
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Natriumhydroxid. PubChem-Datenbank. CID = 14798. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Amerikanische Elemente. (2019). Natriumhydroxidlösung. Wiederhergestellt von: americanelements.com
- Fakten zur chemischen Sicherheit. (2019). Natriumhydroxid. Wiederhergestellt von: chemicsafetyfacts.org
- NJ Gesundheit. (2015). Natriumhydroxid. [PDF]. Wiederhergestellt von: nj.gov
- Kanadisches Zentrum für Gesundheit und Sicherheit am Arbeitsplatz. (2019). Arbeitsschutz Antworten Fact Sheets: Natriumhydroxid. Wiederhergestellt von: ccohs.ca
- Ausetute. (s.f.). Natriumhydroxid- und Chlorproduktion durch Elektrolyse. Wiederhergestellt von: ausetute.com.au



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.