
Magnesiumhydroxidstruktur, Eigenschaften, Nomenklatur, Verwendung
Das Magnesiumhydroxid ist eine anorganische Verbindung mit der chemischen Formel Mg (OH)zwei. In seiner reinen Form ist es ein mattweißer Feststoff mit einem amorphen Aussehen; Mit einem geringen und genauen Gehalt an Verunreinigungen wandelt es sich jedoch in kristallinen festen Brucit um, ein Mineral, das in bestimmten Ablagerungen in der Natur vorkommt, und ist eine reichhaltige Magnesiumquelle..
Es ist ein schwacher Elektrolyt oder eine schwache Base, daher ist seine Dissoziation in Wasser gering. Diese Eigenschaft macht Mg (OH)zwei ein guter Säureneutralisator für den menschlichen Verzehr; Heilmittel im Volksmund als Magnesia-Milch Suspension bekannt. Es ist auch feuerhemmend, indem es während seiner thermischen Zersetzung Wasser freisetzt..

Im oberen Bild sind einige Magnesiumhydroxid-Feststoffe dargestellt, in denen die opake weiße Farbe erkennbar ist. Je kristalliner sie sind, desto glasiger und perliger werden sie.
Seine kristalline Struktur ist eigenartig, da es zweischichtige hexagonale Kristalle bildet, die vielversprechende Designs für das Design neuer Materialien darstellen. In diesen Schichten spielen ihre positiven Ladungen aufgrund der Substitution von Mg eine wichtige Rollezwei+ durch dreiwertige Kationen und die Spezies, die zwischen den Wänden aus OH-Anionen eingeschlossen sind-.
Andererseits ergeben sich andere Anwendungen in Abhängigkeit von der Morphologie der hergestellten Partikel oder Nanopartikel; als Katalysatoren oder Adsorbentien. In allen von ihnen wird das 1: 2-Verhältnis für Mg-Ionen konstant gehalten.zwei+: OH-, reflektiert in der gleichen Formel Mg (OH)zwei.
Artikelverzeichnis
- 1 Struktur
- 1.1 Formel und Oktaeder
- 1.2 Doppelschicht
- 1.3 Morphologien
- 2 Eigenschaften
- 2.1 Aussehen
- 2,2 Molmasse
- 2.3 Dichte
- 2.4 Schmelzpunkt
- 2.5 Löslichkeit in Wasser
- 2.6 Brechungsindex
- 2,7 pH
- 2.8 Wärmekapazität
- 3 Wo befindet es sich??
- 4 Nomenklatur
- 5 Verwendungen
- 5.1 Neutralisator
- 5.2 Antazida
- 5.3 Feuerhemmend
- 5.4 Katalysator
- 5.5 Adsorbens
- 6 Referenzen
Struktur
Formel und Oktaeder
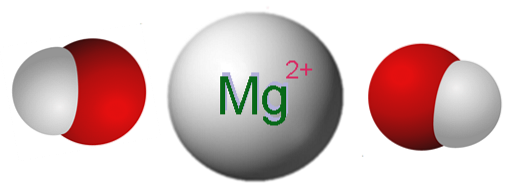
Das Bild oben zeigt die Ionen, aus denen Mg (OH) besteht.zwei. Wie zu sehen ist, gibt es zwei OH-Anionen- für jedes Mg-Kationzwei+, die elektrostatisch interagieren, um einen Kristall mit einer hexagonalen Struktur zu definieren. Die gleiche Formel zeigt an, dass das Mg: OH-Verhältnis 1: 2 beträgt.
Die wahre Kristallstruktur ist jedoch etwas komplizierter als die Annahme einfacher Mg-Ionen.zwei+ und OH-. Tatsächlich zeichnet sich Magnesium durch eine Koordinationszahl von 6 aus, sodass es mit bis zu sechs OH interagieren kann-.
Somit wird das Oktaeder Mg (OH) gebildet6, wo die Sauerstoffatome offensichtlich aus dem OH kommen-;; und die Kristallstruktur beruht nun auf der Betrachtung solcher Oktaeder und wie sie miteinander interagieren.
Tatsächlich sind die Einheiten Mg (OH)6 Am Ende werden zweischichtige Strukturen definiert, die wiederum im Raum angeordnet sind, um den hexagonalen Kristall zu erzeugen.
Doppelschicht
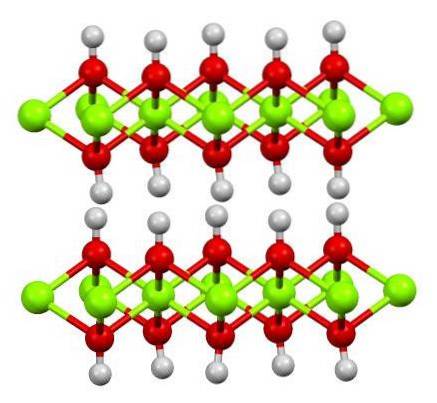
Das obere Bild zeigt die Doppelschichtstruktur von Magnesiumhydroxid (LDH): Geschichtete Doppelhydroxide). Die grünen Kugeln repräsentieren Mg-Ionenzwei+, die durch andere mit einer höheren Ladung ersetzt werden könnten, um eine positive Ladung in der Schicht zu erzeugen.
Beachten Sie, dass um jedes Mgzwei+ Es gibt sechs rote Kugeln, die mit ihren jeweiligen weißen Kugeln verbunden sind. das heißt, die oktaedrischen Einheiten Mg (OH)6. Das OH- fungiert als Brücke, um zwei Mg zu verbindenzwei+ von verschiedenen Ebenen, wodurch die Schichten miteinander verflochten sind.
Ebenso wird beobachtet, dass Wasserstoffatome nach oben und unten zeigen und hauptsächlich für die intermolekularen Kräfte verantwortlich sind, die die beiden Schichten der Mg (OH) -Einheiten zusammenhalten.6.
Neutrale Moleküle (wie Alkohole, Ammoniak und Stickstoff) oder sogar Anionen können sich zwischen diesen Schichten ansammeln, je nachdem, wie positiv sie sind (wenn Al-Ionen vorhanden sind)3+ o Glaube3+ Mg ersetzenzwei+). Der „Füllstoff“ dieser Spezies wird durch die Oberflächen der OH-Anionen begrenzt-.
Morphologien
Doppelschichtiges sechseckiges Glas wächst langsam oder schnell. Es hängt alles von den Synthese- oder Herstellungsparametern ab: Temperatur, Molverhältnis, Rühren, Lösungsmittel, Reagenzien als Quelle für Magnesium, Basen oder Fällungsmittel usw. Wenn der Kristall wächst, definiert er die Mikrostruktur oder Morphologie seiner Nanopartikel oder Aggregate.
Somit können diese Nanopartikel blumenkohlartige platten-, plättchen- oder kügelchenartige Morphologien aufweisen. Ebenso kann sich die Verteilung ihrer Größen ändern, ebenso wie der Porositätsgrad der resultierenden Feststoffe..
Eigenschaften
Aussehen
Es ist ein weißer, körniger oder pulverförmiger Feststoff und geruchlos.
Molmasse
58,3197 g / mol.
Dichte
3,47 g / ml.
Schmelzpunkt
350 ° C. Bei dieser Temperatur zersetzt es sich in Oxid, indem es die in seinen Kristallen enthaltenen Wassermoleküle freisetzt:
Mg (OH)zwei(s) => MgO (s) + H.zweiO (g)
Wasserlöslichkeit
0,004 g / 100 ml bei 100 ° C; Das heißt, es löst sich kaum in kochendem Wasser und ist somit eine unlösliche Verbindung in Wasser. Wenn jedoch der pH-Wert abnimmt (oder der Säuregehalt zunimmt), nimmt seine Löslichkeit aufgrund der Bildung des komplexen wässrigen Mg (OH) zuzwei)6.
Wenn andererseits das Mg (OH)zwei hat CO absorbiertzwei, setzt zurückgehaltenes Gas als Sprudeln frei, wenn es in einem sauren Medium gelöst wird.
Brechungsindex
1,559
pH
Eine wässrige Suspension davon hat einen pH-Wert, der zwischen 9,5 und 10,5 variiert. Obwohl diese Werte normal sind, spiegelt es seine geringe Basizität im Vergleich zu anderen Metallhydroxiden (wie NaOH) wider..
Wärmekapazität
77,03 J / mol K.
Wo befindet es sich??

Magnesiumhydroxid kommt in der Natur als Mineral Brucit vor, das sich durch seine transparente weiße Farbe auszeichnet und je nach Verunreinigung grüne oder bläuliche Töne aufweist. Ebenso ist Brucit Teil einiger Tone wie Chlorit, da es zwischen den Silikatschichten angeordnet ist, die durch Metallionen verbunden sind..
In Brucit gibt es neben Mg noch andere Ionenzwei+, wie Al3+, Vertrauen3+, Znzwei+ und Mnzwei+. Seine Erze kommen in verschiedenen Regionen oder Seen Schottlands, Kanadas, Italiens und der USA vor..
Physikalisch sehen seine Kristalle aus wie geschmolzenes Glas (oberes Bild), mit weißen, grauen, bläulichen oder grünlichen Farben und in seltenen Exemplaren transparent.
Dieses Mineral ist eines der Übel, die Zemente und Beton betreffen, da es dazu neigt, sich auszudehnen und Brüche in ihnen zu verursachen. Es absorbiert jedoch kein COzwei, Daher trägt seine Kalzinierung nicht zum Treibhauseffekt bei und ist daher eine geeignete mineralogische Quelle (und die reichste), um neben Meerwasser auch Magnesium zu erhalten.
Nomenklatur
Mg (OH)zwei Es hat bis zu drei von der IUPAC akzeptierte Namen (außerhalb der Mineralogie oder Medizin). Diese sind einander sehr ähnlich, da die Art und Weise, wie sie enden, kaum variiert..
Zum Beispiel entspricht 'Magnesiumhydroxid' seinem Namen gemäß der Stammnomenklatur, wobei (II) am Ende weggelassen wird, da +2 fast standardmäßig die einzige Oxidationsstufe von Magnesium ist.
'Magnesiumdihydroxid', bezeichnet die Anzahl der OH-Ionen mit dem griechischen Zählerpräfix- angegeben in der Formel gemäß der systematischen Nomenklatur. Und 'Magnesiumhydroxid', das nach der traditionellen Nomenklatur mit dem Suffix -ico endet, das die maximale und „einzige“ Oxidationsstufe von Magnesium darstellt..
Die anderen Namen wie Brucit oder Milchmagnesia stehen zwar in direktem Zusammenhang mit dieser Verbindung, es ist jedoch nicht ratsam, sie in Bezug auf ihren reinsten Feststoff oder als anorganische Verbindung (Reagenz, Rohmaterial usw.) zu bezeichnen..
Anwendungen
Neutralisator
Mg (OH)zwei Es verdankt seine geringe Löslichkeit in Wasser der Tatsache, dass es ein ausgezeichneter Säureneutralisator ist; Andernfalls würde das Medium durch Bereitstellung großer Konzentrationen von OH-Ionen basisch gemacht-, genau wie andere Basen (starke Elektrolyte).
Somit ist Mg (OH)zwei setzt kaum OH frei-, während mit H-Ionen reagieren3ODER+ um den oben erwähnten wässrigen Komplex von Magnesium zu bilden. Da es den Säuregehalt wässriger Medien neutralisieren kann, ist es für die Abwasserbehandlung vorgesehen.
Es ist auch ein Zusatz zu Lebensmitteln, Düngemitteln und bestimmten Körperpflegeprodukten wie Zahnpasta, da es deren Säuregehalt verringert..
Antazida
Da es in Wasser schwer löslich ist, kann es aufgenommen werden, ohne die Auswirkungen seiner OH-Ionen zu gefährden- (dissoziiert sehr wenig als schwacher Elektrolyt).
Diese Eigenschaft, die mit dem obigen Unterabschnitt verbunden ist, macht es zu einem Antazida zur Behandlung von Sodbrennen, Magen-Darm-Erkrankungen, Verdauungsstörungen und Verstopfung, das unter der Formel der Magnesia-Milch verkauft wird.
Andererseits hilft Magnesia-Milch auch bei der Bekämpfung von lästigen Krebsgeschwüren (den weißen und roten Wunden, die im Mund auftreten)..
Feuerdämmend
Im Eigenschaftenbereich wurde erwähnt, dass Mg (OH)zwei zersetzt freisetzendes Wasser. Dieses Wasser hilft gerade dabei, das Fortschreiten der Flammen zu stoppen, da sie Wärme absorbieren, um zu verdampfen, und die Dämpfe wiederum die brennbaren oder brennbaren Gase verdünnen.
Brucitmineral wird üblicherweise industriell für diesen Zweck verwendet und ist als Füllstoff für bestimmte Materialien bestimmt, wie z. B. Kunststoffe aus verschiedenen Polymeren (PVC, Harze, Kautschuke), Kabel oder Decken..
Katalysator
Mg (OH)zwei Es wurde gezeigt, dass es als Nanoplatten synthetisiert ist und chemische Reduktionen effizient katalysiert. zum Beispiel das von 4-Nitrophenol (Ph-NOzwei) zu 4-Aminophenol (Ph-NHzwei). Sie haben auch antibakterielle Aktivität, so dass es als therapeutisches Mittel verwendet werden könnte..
Adsorbens
Einige Feststoffe von Mg (OH)zwei Sie können je nach Herstellungsverfahren ziemlich porös sein. Daher finden sie Anwendung als Adsorbentien.
In wässrigen Lösungen können sie (auf ihren Oberflächen) die Farbstoffmoleküle adsorbieren und das Wasser klären. Zum Beispiel sind sie in der Lage, den in Wasserströmen vorhandenen Indigo-Karmin-Farbstoff zu adsorbieren..
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Magnesiumhydroxid. Wiederhergestellt von: en.wikipedia.org
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Magnesiumhydroxid. PubChem-Datenbank. CID = 14791. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Amethyst Galerien. (2014). Das Mineral Brucit. Wiederhergestellt von: galleries.com
- Henrist et al. (2003). Morphologische Untersuchung von Magnesiumhydroxid-Nanopartikeln
- in verdünnter wässriger Lösung ausgefällt. Journal of Crystal Growth 249, 321 & ndash; 330.
- Saba J., Shanza R.K., Muhammad R.S. (2018). Synthese und Strukturanalyse von mesoporösen Magnesiumhydroxid-Nanopartikeln als effizienter Katalysator.
- Thimmasandra Narayan Ramesh und Vani Pavagada Sreenivasa. (2015). Entfernung von Indigo-Karmin-Farbstoff aus wässriger Lösung unter Verwendung von Magnesiumhydroxid als Adsorbens. Journal of Materials, vol. 2015, Artikel-ID 753057, 10 Seiten. doi.org/10.1155/2015/753057
Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.