
Mindestformel Wie erhalte ich die Mindestformel, Beispiele und Übungen?
Das minimale oder empirische Formel Es ist ein Ausdruck des Anteils, in dem die Atome der verschiedenen Elemente, aus denen eine chemische Verbindung besteht, vorhanden sind. Die Minimalformel ist somit die einfachste Darstellung einer chemischen Verbindung. Deshalb ist es "minimal".
Die Mindestformel drückt nicht die Anzahl der Atome der verschiedenen Elemente aus, aus denen eine chemische Verbindung besteht. aber das Verhältnis, in dem sich diese Atome verbinden, um die chemische Verbindung zu erzeugen.
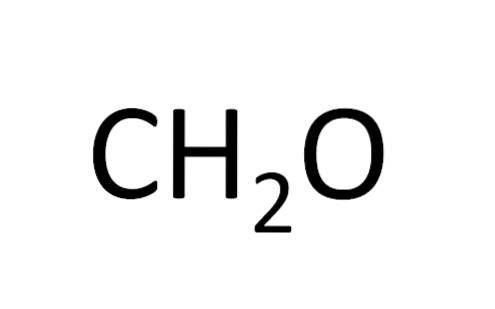
Die Minimalformel wird auch als empirische Formel bezeichnet, da sie aus Experimenten erhalten wird; das heißt, es hängt mit der Erfahrung zusammen. Experimentelle Beobachtungen ließen den Schluss zu, dass sich zwei Wasserstoffatome mit einem Wasserstoffatom zu Wasser verbinden (H.zweiODER).
In vielen Fällen stimmt die Mindestformel mit der Summenformel überein. Im Molekül erscheinen die reellen Zahlen der verschiedenen Elemente, aus denen eine chemische Verbindung besteht; Dies ist beispielsweise bei Schwefelsäure (H) der FallzweiSW4).
In anderen Fällen gibt es jedoch keine Übereinstimmung zwischen der Mindestformel und der Molekülformel. Dies ist der Fall bei Benzol: Die Mindestformel lautet CH, während die Summenformel C lautet6H.6.
Artikelverzeichnis
- 1 So erhalten Sie die Mindestformel?
- 1.1 Erster Schritt
- 1.2 Zweiter Schritt
- 1.3 Dritter Schritt
- 1.4 Vierter Schritt
- 2 Beispiele für Mindestformeln
- 2.1 Wasser und Kohlendioxid
- 2.2 Basische und saure Oxide
- 2.3 Essigsäure
- 2.4 Buttersäure
- 2.5 Ethylenglykol
- 2,6 Benzol
- 2.7 Glukose
- 3 Gelöste Übungen
- 3.1 - Übung 1
- 3.2 - Übung 2
- 4 Referenzen
So erhalten Sie die Mindestformel?
Erster Schritt
Finden Sie die Gramm jedes in der Verbindung vorhandenen Elements. Da sie normalerweise als Prozentsatz der Masse der Verbindung ausgedrückt werden, muss eine einfache Berechnung für die Umwandlung der Massenprozentsätze in Masse der Elemente durchgeführt werden.
Zweiter Schritt
Man erhält die relative Anzahl der Atome der verschiedenen Elemente, aus denen die chemische Verbindung besteht. Dazu wird die Masse jedes Elements, ausgedrückt in Gramm, durch seine Atommasse geteilt.
Einige Autoren bevorzugen es, die relative Anzahl der Atome als die Anzahl der Mol Atome der Elemente zu bezeichnen, die Teil der chemischen Verbindung sind.
Dritter Schritt
Erhalten des in ganzen Zahlen ausgedrückten Mindestanteils jedes der in der chemischen Verbindung vorhandenen Atome.
Um diese Werte zu ermitteln, teilen Sie die relativen Zahlen jedes in der Verbindung vorhandenen Atoms durch den minimalen relativen numerischen Wert, den ein Atom in der chemischen Verbindung hat..
Für den Fall, dass der Wert des Mindestanteils eines Atoms keine ganze Zahl ohne Dezimalstellen ist, müssen alle Werte des Mindestanteils mit einer Zahl multipliziert werden. so, dass alle Werte des Mindestanteils ganze Zahlen sein können.
Wenn beispielsweise der Wert des Mindestanteils eines Atoms der chemischen Verbindung 2,5 beträgt, multiplizieren Sie jeder Die Werte des minimalen Anteils jedes der Atome sind mal 2 vorhanden. Somit sind alle Werte des minimalen Anteils nur ganze Zahlen.
Vierter Schritt
Schreiben Sie die Mindestformel der Verbindung. Die Werte des Mindestanteils für die Atome der verschiedenen Elemente werden als Indizes der chemischen Symbole der Elemente platziert, um die Mindestformel zu schreiben.
Beispiele für Mindestformeln
Wasser und Kohlendioxid
Die meisten chemischen Verbindungen haben Formeln, die sowohl minimale als auch molekulare Formeln sind. Somit ist die Formel für Wasser (H.zweiO) ist eine Minimalformel; es ist aber auch eine Summenformel. Gleiches gilt für die Formel für Kohlendioxid (COzwei).
Basische und saure Oxide
Basische und saure Oxide sind chemische Verbindungen mit chemischen Formeln, mit wenigen Ausnahmen, die sowohl minimale als auch molekulare Formeln sind. Die gleiche Situation tritt bei Hydroxiden und Säuren mit Ausnahme einiger Carbonsäuren auf..
Essigsäure
Carbonsäuren mit einer geraden Anzahl von Kohlenstoffatomen in ihrer Zusammensetzung haben getrennt eine Mindestformel und eine Molekülformel. Essigsäure hat zum Beispiel eine Summenformel (C.zweiH.4ODERzwei); es hat aber auch eine minimale Formel (CHzweiODER).
Buttersäure
Buttersäure hat auch eine Summenformel (C.4H.8ODERzwei) und eine Minimalformel (C.zweiH.4ODER).
Ethylenglykol
Andere organische Verbindungen haben beide Arten von chemischen Formeln; Dies ist der Fall bei Ethylenglykol, das eine Summenformel (C) hatzweiH.6ODERzwei) und eine Minimalformel (CH3ODER).
Benzol
Benzol, eine aromatische Verbindung, hat eine Summenformel (C.6H.6) und eine Minimalformel (CH).
Glucose
Glucose hat eine Summenformel (C.6H.12ODER6) und eine Minimalformel (CHzweiODER).
Gelöste Übungen
- Übung 1
Ethylenglykol ist eine als Frostschutzmittel verwendete Verbindung, hat ein Molekulargewicht von 62,1 g / mol und einen Massenanteil wie folgt:
C: 38%,
H: 9,7%
Oder: 51,16%.
Erster Schritt
Drücken Sie die Massenprozentsätze der Elemente in ihren Massen in Gramm aus. Hierzu wird das Molekulargewicht von Ethylenglykol als Referenz herangezogen. Wenn dies 62,1 Gramm pro Mol sind, bestehen 38% davon aus Kohlenstoff. Und so weiter mit den anderen Elementen:
Kohlenstoffmasse = 62,1 g (38/100)
= 23,6 g
Wasserstoffmasse = 62,1 g (9,7 / 100)
= 6,024 g
Sauerstoffmasse = 62,1 g (51,16 / 100)
= 31,77 g
Zweiter Schritt
Berechnen Sie die relative Anzahl jedes vorhandenen Atoms (NRA) oder die Anzahl der Mol jedes Atoms. Dazu wird die Masse jedes chemischen Elements durch seine Atommasse geteilt.
NRA (C) = 23,6 g / 12 g
= 1,97
Kann auf 2 gerundet werden.
NRA (H) = 6,024 g / 1 g
= 6,024
Kann auf 6 gerundet werden.
NRA (O) = 31,77 g / 16 g
= 1,985
Kann auf 2 gerundet werden.
Dritter Schritt
Berechnen Sie das minimale Ganzzahlverhältnis der Elemente der Verbindung (PMNE). Teilen Sie dazu jeden der Werte der atomaren relativen Zahlen (NRA) durch den kleinsten Wert davon. In diesem Fall 2.
PMNE (C) = 2/2
= 1
PMNE (H) = 6/2
= 3
PMNE (O) = 2/2
= 1
Vierter Schritt
Schreiben Sie die Mindestformel für Ethylenglykol:
CH3ODER
Wie zu sehen ist, sind die in Schritt 3 erhaltenen Werte die Indizes der Elemente der Verbindung.
- Übung 2
Essigsäure hat ein Molekulargewicht von 60 g / mol und die folgende Massenprozentzusammensetzung:
C: 40%
H: 6,67%
Oder: 53,33%
Erhalten Sie die Mindestformel der Verbindung.
Erster Schritt
Wandeln Sie die Massenprozentsätze der Elemente in ihre in Gramm ausgedrückten Massen um:
Kohlenstoffmasse = 60 g (40/100)
= 24 g
Wasserstoffmasse = 60 g (6,67 / 100)
= 4 g
Sauerstoffmasse = 60 g (53,33 / 100)
= 32 g
Zweiter Schritt
Berechnen Sie die relative Anzahl der Atome (NRA) der Verbindung. Dazu werden die Massen der Elemente durch ihre Atommassen geteilt:
NRA (C) = 24 g / 12 g
= 2
NRA (H) = 4 g / 1 g
= 4
NRA (O) = 32 g / 16 g
= 2
Dritter Schritt
Ermitteln Sie das minimale Ganzzahlverhältnis der Elemente der Verbindung (PMNE). Dazu werden die NRA-Werte der Elemente durch den niedrigsten NRA-Wert eines Elements geteilt:
PMNE (C) = 2/2
= 1
PMNE (H) = 4/2
= 2
PMNE (O) = 2/2
= 1
Vierter Schritt
Schreiben Sie die Mindestformel für Essigsäure:
CHzweiODER
Die Indizes der Verbindung sind die von PMNE erhaltenen Werte.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Helmenstine, Anne Marie, Ph.D. (27. August 2019). Empirische Formel: Definition und Beispiele. Wiederhergestellt von :oughtco.com
- Wikipedia. (2020). Empirische Formel. Wiederhergestellt von: en.wikipedia.org
- Chemie LibreTexts. (3. Juli 2019). Berechnung empirischer Formeln für Verbindungen. Wiederhergestellt von: chem.libretexts.org
- Nicola McDougal. (2020). Empirische Formel: Definition, Schritte und Beispiele. Studie. Wiederhergestellt von: study.com


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.