
Strukturformel (mit Beispielen)
Das Strukturformel Es ist eine grafische Darstellung der Bindungen eines Moleküls, die Licht auf seine Struktur wirft, sobald sie mit spektroskopischen Methoden bestimmt wurde. Dies ist der spezifischste Weg, wenn auf eine bestimmte Verbindung Bezug genommen wird und nicht auf mehrere Isomere, die derselben Molekülformel entsprechen.
Zum Beispiel Butan, C.4H.10, hat zwei Isomere: n-Butan (linear) und 2-Methylpropan (verzweigt). Die Summenformel unterscheidet nicht zwischen beiden; Wenn wir auf Strukturformeln zurückgreifen, wird man genau sehen, dass eine linear und die andere verzweigt ist.
Die Verwendung von Strukturformeln erleichtert das Verständnis der Veränderungen, die ein Molekül während einer chemischen Reaktion erfährt. Welche seiner Verknüpfungen sind unterbrochen, wie wird ihre Struktur im Prozess und am Ende geändert? Das Lesen dieser Formeln zu lernen ist dasselbe wie die oberflächlichen Vorhersagen der Eigenschaften von Molekülen.
Strukturformeln sind 2D-Darstellungen, obwohl sie einige dreidimensionale und geometrische Aspekte anzeigen können. Je genauer die Struktur einer Verbindung untersucht wird, desto verfeinerter und originalgetreuer wird ihre Strukturformel. Ansonsten bleiben wesentliche Aspekte aus, um die Natur des Moleküls zu verstehen.
Artikelverzeichnis
- 1 Beispiele für Strukturformeln
- 1.1 Glukose
- 1.2 Methan
- 1.3 Methanol
- 1.4 Ethanol
- 1.5 Fruktose
- 1.6 Wasser
- 1,7 Aspirin
- 1,8 Benzol
- 2 Referenzen
Beispiele für Strukturformeln
Jede Verbindung hat ihre jeweilige Strukturformel, die je nach Art der Projektion oder Perspektive variieren kann. Beispielsweise sind kondensierte und Skelettformeln, Lewis-Strukturen und stereochemische Projektionen Strukturformeln, mit denen so viele Informationen wie möglich über die Molekülstruktur grafisch dargestellt werden sollen..
Es gibt so viele, dass nur einige einfache Beispiele angesprochen werden..
Glucose

Im oberen Bild sind vier Darstellungen des Glucosemoleküls dargestellt. Jedes ist eine gültige Strukturformel; 2 (Haworth-Projektion) und 3 (Stuhlprojektion) werden jedoch normalerweise am häufigsten in akademischen Texten und Veröffentlichungen verwendet.
Die 4 hat den Vorteil, dass sie direkt anzeigt, welche OH-Gruppen über (dicke Keile) oder unter (gepunktete Keile) dem hexagonalen Ring liegen; das heißt, es erleichtert das Verständnis seiner Stereochemie. Im Gegensatz dazu zeigt die 1 (Tollens-Fisher-Projektion) den linearen Charakter von Glucose, bevor sie in ihre zyklische Form umgewandelt wird.
Methan
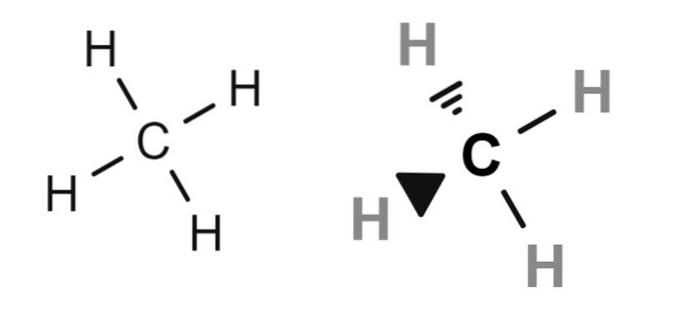
Oben befinden sich zwei Strukturformeln von Methan, dessen kondensierte Molekülformel CH ist4. Für diejenigen, die keine Kenntnisse der Chemie haben, könnten sie die Formel CH interpretieren4 als wäre es ein Molekül mit einem Wasserstoffatom im Zentrum.
In Wirklichkeit (und notwendigerweise) machen die Strukturformeln deutlich, dass Kohlenstoff das Zentralatom ist. Daher haben wir vier CH-Bindungen. Beachten Sie auch, dass die Formel links den falschen Eindruck erweckt, dass das Molekül flach ist, obwohl es in Wirklichkeit tetraedrisch ist (Formel rechts)..
Deshalb werden in der Strukturformel rechts die Bindungen durch Keile dargestellt, die die relativen räumlichen Positionen jedes Wasserstoffatoms (Eckpunkte des Tetraeders) angeben..
Methanol

Die Strukturformel von Methanol ist praktisch dieselbe wie die von Methan, mit dem Unterschied, dass ein H durch ein OH substituiert ist. Seine kondensierte oder chemische Formel lautet CH3OH und das molekulare CH4O. Es wird beobachtet, dass es auch aus einem Tetraeder besteht.
Ethanol
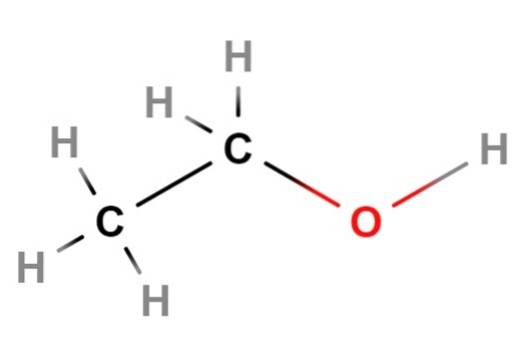
Nun gehen wir zu Ethanol über, dem nächsten Alkohol auf der Liste. Seine chemische oder kondensierte Formel lautet CH3CHzweiOH, das an sich schon seine lineare Struktur zeigt. Natürlich zeigt die Strukturformel im obigen Bild effektiv, dass Ethanol eine lineare Kette oder ein Gerüst ist..
Wenn Sie genau hinschauen, ist die Umgebung jedes Kohlenstoffatoms tetraedrisch.
Fruktose

Oben haben wir die Strukturformel von Fructose, genauer gesagt die Haworth-Projektion seines Furanusrings (fünfgliedrig). Man beachte, wie viel die Strukturformel im Gegensatz zur molekularen Formel C offenbart6H.12ODER6, was mit dem von Glucose übereinstimmt, wobei beide jedoch unterschiedliche Zucker sind.
Wasser

Die chemische Formel von Wasser lautet H.zweiOder entsprechend auch den kondensierten und molekularen Formeln. Wie bei Methan können diejenigen, die das Wassermolekül nicht kennen (und keine Ahnung von chemischen Bindungen haben), glauben, dass seine Struktur O-H-H ist; Die Strukturformel im obigen Bild verdeutlicht jedoch die wahre Struktur.
Obwohl dies nicht erkannt wird, ziehen die Paare freier Elektronen aus Sauerstoff- und Wasserstoffatomen ein Tetraeder um den Sauerstoff; Dies ist die elektronische Geometrie von Wasser: tetraedrisch. Währenddessen bilden die beiden Wasserstoffatome eine Ebene ähnlich einem Bumerang. Dies ist die molekulare Geometrie von Wasser: eckig.
Obwohl die Strukturformel von Wasser bei weitem das einfachste der diskutierten Beispiele ist, verbirgt sie mehr Geheimnisse und Anomalien, als sie allein darstellen kann..
Aspirin
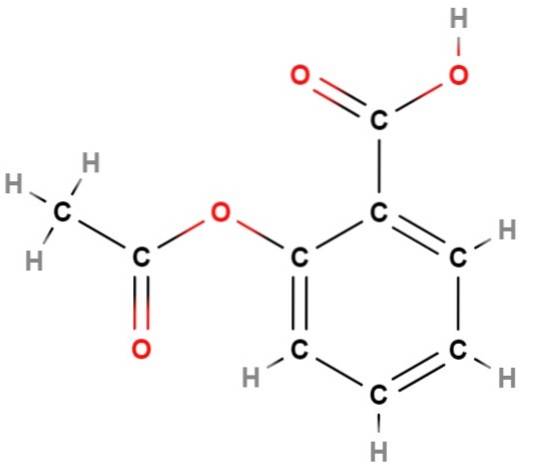
Wir haben eines der ersten "Fehler" von Strukturformeln: ihre Unfähigkeit, den aromatischen Charakter einer Struktur darzustellen; was in diesem Fall der Aromatizität des Benzolrings (hexagonal) von Aspirin entspricht (oben).
Wenn Sie sich diese Formel genau ansehen, werden Sie zu dem Schluss kommen, dass es sich um ein im Wesentlichen flaches Molekül handelt. das heißt, fast alle seiner Atome "ruhen" in derselben Ebene, mit Ausnahme der Methylgruppe CH3, links, wo die tetraedrische Umgebung von Kohlenstoff erneut sichtbar gemacht wird.
Auch hier liefert die Strukturformel viel mehr Informationen als ihre einfache Molekülformel C.9H.8ODER4;; Dies entspricht zahlreichen Strukturisomeren, die sich völlig von Aspirin unterscheiden.
Benzol
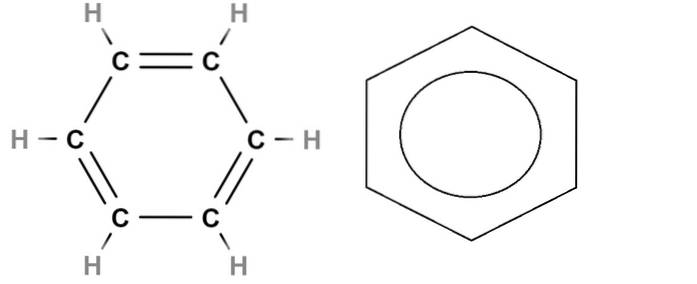
Zum Schluss haben wir oben die Strukturformel von Benzol. Seine Summenformel lautet C.6H.6, Dies zeigt an, dass es sechs Kohlenstoffatome und sechs Wasserstoffatome enthält. Aber es sagt nichts über die wahre Struktur von Benzol aus.
Die C = C-Doppelbindungen sind nicht statisch, da sich ein Elektronenpaar befindet, insbesondere dasjenige, das sich in den Orbitalen befindet p von Kohlenstoff ist es innerhalb des Rings delokalisiert. Folglich hat Benzol mehrere Resonanzstrukturen, von denen jede ihre eigene Strukturformel hat..
Diese Delokalisierung ist Teil des aromatischen Charakters von Benzol, der in der Strukturformel links nicht genau dargestellt ist. Am nächsten ist es, die Doppelbindungen durch einen Kreis zu ersetzen (von manchen als Donut bezeichnet), um die Aromatizität des Rings anzuzeigen (rechts im Bild)..
Und was ist mit der Skelettformel? Dies ist dem strukturellen sehr ähnlich und unterscheidet sich nur darin, dass es keine Wasserstoffatome darstellt; Daher ist die grafische Darstellung einfacher und komfortabler. Der Benzolring rechts wäre seine Skelettformel.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). CENGAGE Lernen.
- Wikipedia. (2020). Strukturformel. Wiederhergestellt von: en.wikipedia.org
- Nissa Garcia. (2020). Strukturformel: Definition & Beispiele. Studie. Wiederhergestellt von: study.com
- Clark Jim. (2012). Organische Moleküle zeichnen. Wiederhergestellt von: chemguide.co.uk
- William Reusch. (5. Mai 2013). Die Form der Moleküle. Wiederhergestellt von: 2.chemistry.msu.edu


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.