
Struktur, Eigenschaften, Verwendung, Synthese der Hypochlorsäure (HClO)

Das Hypochlorsäure Es ist eine anorganische Verbindung, deren chemische Formel HClO ist. Es entspricht der am wenigsten oxidierten Chloroxidsäure, da es nur ein Sauerstoffatom enthält. Daraus leiten sie das Hypochloritanion ClO ab-, und seine Salze, die häufig als handelsübliche Wasserdesinfektionsmittel verwendet werden.
HClO ist das stärkste oxidierende und antimikrobielle Mittel, das entsteht, wenn sich Chlorgas in Wasser löst. Seine antiseptische Wirkung ist seit mehr als einem Jahrhundert bekannt, noch bevor im Ersten Weltkrieg Chlorlösungen zur Reinigung der Wunden von Soldaten verwendet wurden..
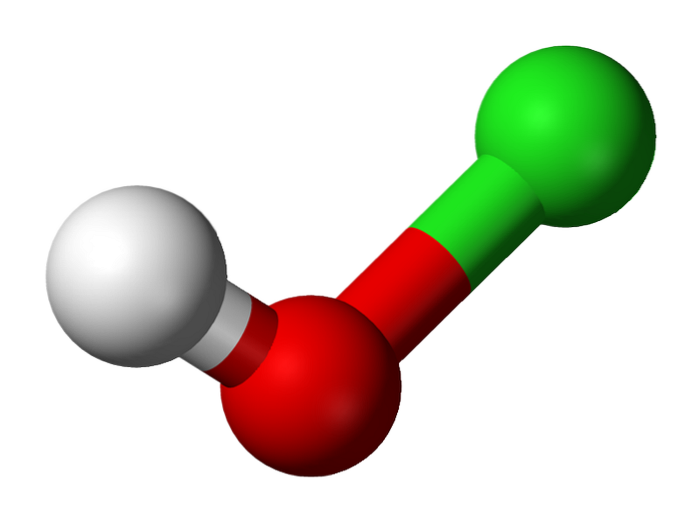
Seine Entdeckung geht auf das Jahr 1834 des französischen Chemikers Antoine Jérôme Balard zurück, der die partielle Oxidation von Chlor durch Einblasen in eine wässrige Suspension von Quecksilberoxid, HgO, erreichte. Seitdem wird es als Desinfektionsmittel und als antivirales Mittel verwendet..
Chemisch gesehen ist HClO ein Oxidationsmittel, das sein Chloratom an andere Moleküle abgibt. Mit anderen Worten, damit können chlorierte Verbindungen synthetisiert werden, wobei Chloramine für die Entwicklung neuer Antibiotika von großer Bedeutung sind..
In den 1970er Jahren wurde entdeckt, dass der Körper in der Lage ist, diese Säure auf natürliche Weise durch die Wirkung des Enzyms Myeloperoxidase zu produzieren. Enzym, das während der Phagozytose auf Peroxide und Chloridanionen wirkt. So kann aus demselben Organismus dieser "Mörder" von Eindringlingen hervorgehen, jedoch in harmlosem Ausmaß für sein eigenes Wohlergehen..
Artikelverzeichnis
- 1 Struktur
- 2 Eigenschaften
- 2.1 Säure
- 2.2 Oxidationsmittel
- 2.3 Stabilität
- 3 Synthese
- 3.1 Wasser und Chlor
- 3.2 Elektrolyse
- 4 Verwendungen
- 4.1 Allgemeine Aspekte
- 4.2 Desinfektion und Reinigung
- 5 Risiken
- 6 Referenzen
Struktur
Das obere Bild zeigt die Struktur von HClO. Es ist zu beachten, dass die Formel der Struktur widerspricht: Das Molekül ist H-O-Cl und nicht H-Cl-O; Letzteres wird jedoch normalerweise bevorzugt, um es direkt mit seinen stärker oxidierten Gegenstücken vergleichen zu können: HClOzwei, HClO3 und HClO4.
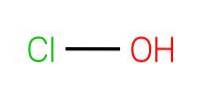
Saurer Wasserstoff, H.+, Das durch HClO freigesetzte befindet sich an der an das Chloratom gebundenen OH-Gruppe. Beachten Sie auch die bemerkenswerten Längenunterschiede in den O-H- und Cl-O-Bindungen, wobei letztere aufgrund der geringeren Überlappung der Chlororbitale, die diffuser sind, mit denen von Sauerstoff am längsten sind..
Das HOCl-Molekül kann unter normalen Bedingungen kaum stabil bleiben; kann nicht aus seinen wässrigen Lösungen isoliert werden, ohne unverhältnismäßig zu sein oder als Chlorgas freigesetzt zu werden, Clzwei.
Daher gibt es keine wasserfreien Kristalle (nicht einmal Hydrate davon) von Hypochlorsäure; Und bis heute gibt es auch keinen Hinweis darauf, dass sie mit extravaganten Methoden hergestellt werden können. Wenn sie kristallisieren könnten, würden die HClO-Moleküle über ihre permanenten Dipole (negative Ladungen, die auf Sauerstoff ausgerichtet sind) miteinander interagieren..
Eigenschaften
Säure
HClO ist eine monoprotische Säure; Das heißt, Sie können nur ein H spenden+ zu dem wässrigen Medium (wo es gebildet wird):
HClO (aq) + H.zweiO ↔ ClO-(ac) + H.3ODER+(ac) (pKa = 7,53)
Aus dieser Gleichgewichtsgleichung wird beobachtet, dass eine Abnahme der H-Ionen3ODER+ (eine Erhöhung der Basizität des Mediums) begünstigt die Bildung von mehr Hypochloritanionen, ClO-. Folglich, wenn Sie eine Lösung von ClO relativ stabil halten möchten- Der pH-Wert muss basisch sein, was mit NaOH erreicht wird.
Seine Dissoziationskonstante pKa stellt in Frage, dass HClO eine schwache Säure ist. Wenn Sie es konzentriert handhaben, müssen Sie sich daher nicht so viele Sorgen um die H-Ionen machen3ODER+, aber durch das HClO selbst (aufgrund seiner hohen Reaktivität und nicht wegen seiner Korrosivität).
Oxidationsmittel
Es wurde erwähnt, dass das Chloratom in HClO eine Oxidationszahl von +1 aufweist. Dies bedeutet, dass es kaum der Verstärkung eines einzelnen Elektrons bedarf, um in seinen Grundzustand zurückzukehren (Cl0) und in der Lage sein, das Molekül Cl zu bildenzwei. Folglich wird das HClO zu Cl reduziertzwei und H.zweiOder eine andere Spezies schneller oxidieren als das gleiche Clzwei oder ClO-::
2HClO (aq) + 2H+ + 2e- ↔ Clzwei(g) + 2HzweiO (l)
Diese Reaktion ermöglicht es uns bereits zu sehen, wie stabil HClO in seinen wässrigen Lösungen ist..
Seine Oxidationskraft wird nicht nur durch die Bildung von Cl gemessenzwei, sondern auch wegen seiner Fähigkeit, sein Chloratom aufzugeben. Beispielsweise kann es mit stickstoffhaltigen Spezies (einschließlich Ammoniak und stickstoffhaltigen Basen) unter Bildung von Chloraminen reagieren:
HClO + N-H → N-Cl + H.zweiODER
Es ist zu beachten, dass eine N-H-Bindung einer Aminogruppe (-NHzwei) meistens und wird durch ein N-Cl ersetzt. Gleiches gilt für die O-H-Bindungen von Hydroxylgruppen:
HClO + O-H → O-Cl + H.zweiODER
Diese Reaktionen sind entscheidend und erklären die desinfizierende und antibakterielle Wirkung von HClO..
Stabilität
HClO ist fast überall instabil, wo man es betrachtet. Beispielsweise ist das Hypochloritanion in Chlorspezies mit Oxidationszahlen von -1 und +5 unverhältnismäßig, stabiler als +1 in HClO (H.+Cl+ODERzwei-):
3ClO-(aq) ≤ 2Cl-(ac) + ClO3-(ac)
Diese Reaktion würde das Gleichgewicht wieder in Richtung des Verschwindens von HClO verschieben. Ebenso ist HClO direkt an einem parallelen Gleichgewicht mit Wasser und Chlorgas beteiligt:
Clzwei(g) + H.zweiO (l) ↔ HClO (aq) + H.+(ac) + Cl-(ac)
Aus diesem Grund führt der Versuch, eine HClO-Lösung zu erhitzen, um sie zu konzentrieren (oder zu isolieren), zur Produktion von Clzwei, welches als gelbes Gas identifiziert wird. Ebenso können diese Lösungen nicht zu lange Licht oder Metalloxiden ausgesetzt werden, da sie Cl zersetzenzwei (HClO verschwindet noch mehr):
2Clzwei + 2HzweiO → 4HCl + O.zwei
HCl reagiert mit HClO, um mehr Cl zu erzeugenzwei::
HClO + HCl → Clzwei + H.zweiODER
Und so weiter, bis es kein HClO mehr gibt.
Synthese
Wasser und Chlor
Eine der Methoden zur Herstellung oder Synthese von Hypochlorsäure wurde bereits implizit erklärt: das Auflösen von Chlorgas in Wasser. Ein anderes ziemlich ähnliches Verfahren besteht darin, das Anhydrid dieser Säure in Wasser zu lösen: Dichlormonoxid, ClzweiODER:
ClzweiO (g) + H.zweiO (l) ≤ 2HClO (aq)
Auch hier gibt es keine Möglichkeit, reines HClO zu isolieren, da das Verdampfen des Wassers das Gleichgewicht zur Bildung von Cl verschieben würdezweiOder Gas, das aus dem Wasser entweichen würde.
Andererseits war es möglich, konzentriertere Lösungen von HClO (20%) unter Verwendung von Quecksilberoxid, HgO, herzustellen. Dazu wird Chlor gerade an seinem Gefrierpunkt in einem Wasservolumen so gelöst, dass ein chloriertes Eis entsteht. Dann wird dasselbe Eis gerührt und mischt sich beim Schmelzen mit dem HgO:
2Clzwei + HgO + 12HzweiO → 2HClO + HgClzwei + 11HzweiODER
Die 20% ige HClO-Lösung kann schließlich vakuumdestilliert werden.
Elektrolyse
Eine einfachere und sicherere Methode zur Herstellung von Hypochlorsäurelösungen besteht darin, anstelle von Chlor Salzlösungen als Rohmaterial zu verwenden. Salzlösungen sind reich an Chloridanionen, Cl-, welches durch einen Elektrolyseprozess zu Cl oxidiert werden kannzwei::
2HzweiO → O.zwei + 4H+ + 4e- -
2Cl- - E 2e- - + Clzwei
Diese beiden Reaktionen finden an der Anode statt, an der Chlor entsteht, das sich sofort auflöst und zu HClO führt. Im Kathodenraum wird das Wasser reduziert:
2HzweiO + 2e- - → 2OH- - + H.zwei
Auf diese Weise kann HClO im kommerziellen bis industriellen Maßstab synthetisiert werden; und diese aus Salzlösungen erhaltenen Lösungen sind tatsächlich die im Handel erhältlichen Produkte dieser Säure.
Anwendungen
Allgemeine Merkmale
HClO kann als Oxidationsmittel verwendet werden, um Alkohole zu Ketonen zu oxidieren und Chloramine, Chloramide oder Chlorhydrine (ausgehend von Alkenen) zu synthetisieren..
Alle anderen Verwendungen können jedoch in einem Wort zusammengefasst werden: Biozid. Es ist ein Killer für Pilze, Bakterien, Viren und ein Neutralisator von Toxinen, die von Krankheitserregern freigesetzt werden.
Das Immunsystem unseres Körpers synthetisiert sein eigenes HClO durch die Wirkung des Enzyms Myeloperoxidase und hilft den weißen Blutkörperchen, die Eindringlinge auszurotten, die die Infektion verursachen.
Unzählige Studien legen verschiedene Mechanismen der Wirkung von HClO auf die biologische Matrix nahe. Dies spendet sein Chloratom an die Aminogruppen bestimmter Proteine und oxidiert auch deren SH-Gruppen, die an S-S-Disulfidbrücken vorhanden sind, was zu deren Denaturierung führt..
Ebenso stoppt es die DNA-Replikation durch Reaktion mit stickstoffhaltigen Basen, beeinflusst die vollständige Oxidation von Glucose und kann auch die Zellmembran deformieren. All diese Handlungen führen zum Tod von Keimen.
Desinfektion und Reinigung
Aus diesem Grund werden HClO-Lösungen verwendet, um:
-Behandlung von infektiösen Wunden und Brandwunden
-Wasserversorgung desinfizieren
-Sterilisationsmittel für chirurgisches Material oder Werkzeuge, die in der Veterinärmedizin, Medizin und Zahnmedizin verwendet werden
-Desinfektionsmittel für jede Art von Oberfläche oder Gegenstand im Allgemeinen: Stangen, Handläufe, Kaffeemaschinen, Keramik, Glastische, Labortheken usw..
-Synthetisieren Sie Chloramine, die als weniger aggressive Antibiotika dienen, aber gleichzeitig haltbarer, spezifischer und stabiler als HClO selbst sind
Risiken
HClO-Lösungen können gefährlich sein, wenn sie hoch konzentriert sind, da sie mit oxidationsanfälligen Spezies heftig reagieren können. Darüber hinaus neigen sie dazu, bei Destabilisierung gasförmiges Chlor freizusetzen, weshalb sie unter einem strengen Sicherheitsprotokoll gelagert werden müssen..
HClO reagiert so reaktiv auf Keime, dass es dort, wo es gewässert wird, sofort verschwindet, ohne später ein Risiko für diejenigen darzustellen, die die von ihm behandelten Oberflächen berühren. Das gleiche passiert im Organismus: Es zersetzt sich schnell oder wird von allen Arten in der biologischen Umgebung neutralisiert.
Wenn es vom Körper selbst erzeugt wird, ist es wahrscheinlich, dass es niedrige HClO-Konzentrationen tolerieren kann. Wenn es jedoch hoch konzentriert ist (für synthetische Zwecke und nicht für Desinfektionsmittel verwendet), kann es unerwünschte Wirkungen haben, indem es auch gesunde Zellen (z. B. der Haut) angreift..
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Gottardi, W., Debabov, D. & Nagl, M. (2013). N-Chloramine, eine vielversprechende Klasse gut verträglicher topischer Antiinfektiva. Antimikrobielle Mittel und Chemotherapie, 57 (3), 1107-1114. doi: 10.1128 / AAC.02132-12
- Von Jeffrey Williams, Eric Rasmussen und Lori Robins. (06. Oktober 2017). Hypochlorsäure: Nutzung einer angeborenen Reaktion. Wiederhergestellt von: infectioncontrol.tips
- Hydro-Instrumente. (s.f.). Grundlegende Chemie der Chlorierung. Wiederhergestellt von: hydroinstruments.com
- Wikipedia. (2019). Hypochlorsäure. Wiederhergestellt von: en.wikipedia.org
- Serhan Sakarya et al. (2014). Hypochlorsäure: Ein ideales Mittel zur Wundversorgung mit starker mikrobizider, antibakterieller und wundheilender Wirkung. HMP-Wunden. Wiederhergestellt von: Wundenresearch.com
- PrebChem. (2016). Herstellung von Hypochlorsäure. Wiederhergestellt von: prepchem.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.