
Struktur, Eigenschaften, Synthese, Verwendung der Kohlensäure (H2CO3)
Das Kohlensäure Es ist eine anorganische Verbindung, obwohl es diejenigen gibt, die darüber diskutieren, dass es tatsächlich organisch ist, deren chemische Formel H istzweiCO3. Es ist daher eine diprotische Säure, die zwei H-Ionen abgeben kann+ an das wässrige Medium, um zwei molekulare Kationen H zu erzeugen3ODER+. Daraus entstehen die bekannten Bicarbonationen (HCO)3-) und Carbonat (CO3zwei-).
Diese eigentümliche Säure, einfach, aber gleichzeitig in Systemen involviert, in denen zahlreiche Spezies an einem Flüssigkeits-Dampf-Gleichgewicht beteiligt sind, wird aus zwei grundlegenden anorganischen Molekülen gebildet: Wasser und Kohlendioxid. Das Vorhandensein von COzwei ungelöst wird beobachtet, wenn im Wasser Blasen entstehen, die zur Oberfläche hin ansteigen.

Dieses Phänomen tritt sehr regelmäßig bei kohlensäurehaltigen Getränken und kohlensäurehaltigem Wasser auf..
Im Fall von kohlensäurehaltigem oder kohlensäurehaltigem Wasser (Bild oben) wurde eine solche Menge CO gelöstzwei dass sein Dampfdruck mehr als doppelt so hoch ist wie der atmosphärische Druck. Im nicht verschlossenen Zustand verringert der Druckunterschied innerhalb und außerhalb der Flasche die Löslichkeit von COzwei, so erscheinen die Blasen, die aus der Flüssigkeit entweichen.
In geringerem Maße tritt dasselbe in jedem Körper mit frischem oder salzhaltigem Wasser auf: Beim Erhitzen setzen sie ihren gelösten CO-Gehalt frei.zwei.
Der COzwei Es wird nicht nur aufgelöst, sondern unterliegt auch Transformationen in seinem Molekül, die es zu H machenzweiCO3;; Eine Säure, die eine zu geringe Lebensdauer hat, aber ausreicht, um eine messbare Änderung des pH-Werts ihres wässrigen Lösungsmittelmediums zu markieren und ein einzigartiges Carbonatpuffersystem zu erzeugen.
Artikelverzeichnis
- 1 Struktur
- 1.1 Molekül
- 1.2 Molekulare Wechselwirkungen
- 1.3 Reine Kohlensäure
- 2 Eigenschaften
- 3 Synthese
- 3.1 Auflösung
- 3.2 Flüssigkeits-Dampf-Gleichgewicht
- 3.3 Reiner Feststoff
- 4 Verwendungen
- 5 Risiken
- 6 Referenzen
Struktur
Molekül
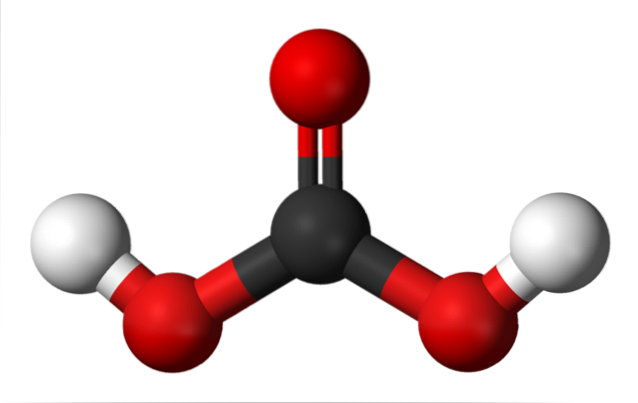
Oben haben wir das H-MolekülzweiCO3, dargestellt mit Kugeln und Balken. Die roten Kugeln entsprechen den Sauerstoffatomen, die schwarzen dem Kohlenstoffatom und die weißen den Wasserstoffatomen.
Beachten Sie, dass Sie ausgehend vom Bild eine andere gültige Formel für diese Säure schreiben können: CO (OH)zwei, wobei CO die Carbonylgruppe C = O wird, die an zwei Hydroxylgruppen OH gebunden ist. Da es zwei OH-Gruppen gibt, die ihre Wasserstoffatome abgeben können, ist nun klar, woher die H-Ionen kommen+ in die Mitte freigegeben.
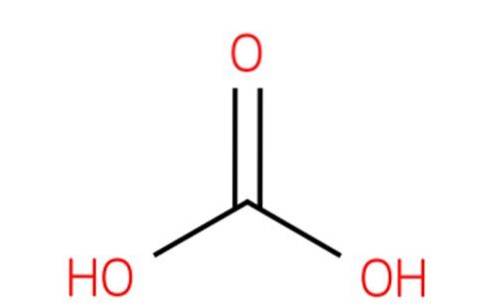
Beachten Sie auch, dass die Formel CO (OH)zwei kann als OHCOOH geschrieben werden; das heißt, vom RCOOH-Typ, wobei R in diesem Fall eine OH-Gruppe ist.
Aus diesem Grund wird Kohlensäure neben der Tatsache, dass das Molekül aus Sauerstoff-, Wasserstoff- und Kohlenstoffatomen besteht, die in der organischen Chemie nur allzu häufig vorkommen, von einigen als organische Verbindung angesehen. Im Abschnitt über seine Synthese wird jedoch erklärt, warum andere es als anorganisch und anorganisch betrachten..
Molekulare Wechselwirkungen
Vom H-MolekülzweiCO3 Es kann kommentiert werden, dass seine Geometrie eine trigonale Ebene ist, wobei sich der Kohlenstoff in der Mitte des Dreiecks befindet. In zwei seiner Eckpunkte hat es OH-Gruppen, die Wasserstoffbrückenbindungsdonoren sind; und im anderen verbleibenden ein Sauerstoffatom der Gruppe C = O, Akzeptor von Wasserstoffbrückenbindungen.
So ist die H.zweiCO3 hat eine starke Tendenz zur Wechselwirkung mit protischen oder sauerstoffhaltigen (und stickstoffhaltigen) Lösungsmitteln.
Und zufällig erfüllt Wasser diese beiden Eigenschaften, und dies ist die Affinität von H.zweiCO3 für sie gibt das ihr fast sofort ein H.+ und es beginnt sich ein Hydrolysegleichgewicht herzustellen, an dem die HCO-Spezies beteiligt ist3- und H.3ODER+.
Deshalb zersetzt die bloße Anwesenheit von Wasser Kohlensäure und macht ihre Isolierung als reine Verbindung zu kompliziert..
Reine Kohlensäure
Zurück zum H-MolekülzweiCO3, Es ist nicht nur flach, in der Lage, Wasserstoffbrücken zu binden, sondern kann auch eine cis-trans-Isomerie aufweisen. Dies ist, in dem Bild haben wir das cis-Isomer, wobei die beiden Hs in die gleiche Richtung zeigen, während sie im trans-Isomer in entgegengesetzte Richtungen zeigen würden.
Das cis-Isomer ist das stabilere der beiden, und deshalb ist es das einzige, das normalerweise dargestellt wird.
Ein reiner Feststoff aus H.zweiCO3 Es besteht aus einer kristallinen Struktur, die aus Schichten oder Schichten von Molekülen besteht, die mit lateralen Wasserstoffbrückenbindungen interagieren. Dies ist mit dem Molekül H zu erwartenzweiCO3 flach und dreieckig. Bei Sublimation cyclische Dimere (H.zweiCO3)zwei, die durch zwei Wasserstoffbrückenbindungen C = O - OH verbunden sind.
Die Symmetrie der H-KristallezweiCO3 konnte im Moment nicht definieren. Es wurde angenommen, dass es als zwei Polymorphe kristallisiert: α-HzweiCO3 und β-HzweiCO3. Α-HzweiCO3, synthetisiert ausgehend von einer Mischung aus CH3COOH-COzwei, es wurde gezeigt, dass es tatsächlich CH ist3OCOOH: ein Monomethylester der Kohlensäure.
Eigenschaften
Es wurde erwähnt, dass der H.zweiCO3 Es ist eine diprotische Säure, die zwei H-Ionen abgeben kann+ zu einem Medium, das sie akzeptiert. Wenn dieses Medium Wasser ist, lauten die Gleichungen seiner Dissoziation oder Hydrolyse:
H.zweiCO3(ac) + H.zweiO (l) <=> HCO3-(ac) + H.3ODER+(ac) (Ka1 = 2,5 × 10−4)
HCO3-(ac) + H.zweiO (l) <=> CO3zwei-(ac) + H.3ODER+(ac) (Kazwei = 4,69 × 10−11)
Das HCO3- ist das Bicarbonat- oder Hydrogencarbonatanion und das CO3zwei- das Carbonatanion. Ebenfalls angegeben sind ihre jeweiligen Gleichgewichtskonstanten Ka1 und Kazwei. Ka seinzwei fünf Millionen Mal kleiner als Ka1, die Bildung und Konzentration von CO3zwei- sie sind verabscheuungswürdig.
Obwohl es sich um eine diprotische Säure handelt, ist das zweite H.+ es kann es kaum nennenswert freigeben. Das Vorhandensein von COzwei in großen Mengen gelöst reicht es aus, das Medium anzusäuern; in diesem Fall senkt das Wasser seine pH-Werte (unter 7).
Von Kohlensäure zu sprechen bedeutet, sich praktisch auf eine wässrige Lösung zu beziehen, in der die HCO-Spezies vorherrschen3- und H.3ODER+;; es kann nicht durch herkömmliche Verfahren isoliert werden, da der kleinste Versuch das Gleichgewicht der CO-Löslichkeit verschieben würdezwei zur Bildung von Blasen, die aus dem Wasser entweichen würden.
Synthese
Auflösung
Kohlensäure ist eine der am einfachsten zu synthetisierenden Verbindungen. Wie? Die einfachste Methode besteht darin, mit Hilfe eines Strohhalms oder eines Strohhalms die Luft, die wir ausatmen, in ein Wasservolumen zu sprudeln. Weil wir im Wesentlichen CO ausatmenzwei, Dies sprudelt im Wasser und löst einen kleinen Teil davon auf.
Wenn wir dies tun, tritt die folgende Reaktion auf:
COzwei(g) + H.zweiO (l) <=> H.zweiCO3(ac)
Aber wiederum muss die Löslichkeit von CO berücksichtigt werden.zwei im Wasser:
COzwei(G) <=> COzwei(ac)
Sowohl der COzwei wie der H.zweiO sind anorganische Moleküle, also die H.zweiCO3 es ist unter diesem Gesichtspunkt anorganisch.
Flüssigkeits-Dampf-Gleichgewicht
Als Ergebnis haben wir ein System im Gleichgewicht, das stark von den Partialdrücken von CO abhängtzwei, sowie die Temperatur der Flüssigkeit.
Zum Beispiel, wenn der Druck von COzwei erhöht sich (für den Fall, dass wir die Luft mit mehr Kraft durch den Strohhalm blasen), wird mehr H gebildetzweiCO3 und der pH wird saurer; da verschiebt sich das erste Gleichgewicht nach rechts.
Wenn wir dagegen die Lösung von H erhitzenzweiCO3, es wird die Löslichkeit von CO verringernzwei in Wasser, weil es ein Gas ist und sich das Gleichgewicht dann nach links verschiebt (es wird weniger H gebenzweiCO3). Ähnlich wird es sein, wenn wir versuchen, ein Vakuum anzulegen: das COzwei es wird ebenso entweichen wie die Wassermoleküle, die das Gleichgewicht wieder nach links verschieben würden.
Rein fest
Das Obige erlaubt es uns, eine Schlussfolgerung zu ziehen: aus einer Lösung von H.zweiCO3 Es gibt keine Möglichkeit, diese Säure mit einem herkömmlichen Verfahren als reinen Feststoff zu synthetisieren. Es wurde jedoch seit den 90er Jahren des letzten Jahrhunderts ausgehend von festen CO-Gemischen durchgeführtzwei und H.zweiODER.
Zu dieser festen Mischung COzwei-H.zweiOder bei 50% wird es mit Protonen (einer Art kosmischer Strahlung) bombardiert, so dass keine der beiden Komponenten entweicht und die Bildung von H auftrittzweiCO3. Zu diesem Zweck wurde auch eine Mischung von CH verwendet.3OH-COzwei (Denken Sie an α-HzweiCO3).
Eine andere Methode besteht darin, dasselbe zu tun, aber Trockeneis direkt zu verwenden, nicht mehr..
Von den drei Methoden konnten NASA-Wissenschaftler zu einer Schlussfolgerung gelangen: Reine Kohlensäure, fest oder gasförmig, kann in den eisigen Satelliten des Jupiter, in Marsgletschern und in Kometen existieren, wo solche festen Gemische ständig von kosmischen Strahlen bestrahlt werden.
Anwendungen
Kohlensäure an sich ist eine nutzlose Verbindung. Aus seinen Lösungen können jedoch Puffer hergestellt werden, die auf den HCO-Paaren basieren.3-/ CO3zwei- oder H.zweiCO3/ HCO3-.
Dank dieser Lösungen und der Wirkung des in roten Blutkörperchen vorhandenen Carboanhydraseenzyms COzwei Bei der Atmung erzeugte Stoffe können im Blut in die Lunge transportiert werden, wo sie schließlich freigesetzt werden, um außerhalb unseres Körpers ausgeatmet zu werden.
Das Sprudeln von COzwei Es wird verwendet, um alkoholfreien Getränken das angenehme und charakteristische Gefühl zu geben, das sie beim Trinken im Hals hinterlassen.
Ebenso ist das Vorhandensein von H.zweiCO3 Es hat geologische Bedeutung bei der Bildung von Kalkstein-Stalaktiten, da es sie langsam auflöst, bis sie ihre spitzen Oberflächen bilden.
Andererseits können seine Lösungen verwendet werden, um einige metallische Bicarbonate herzustellen; obwohl es dafür rentabler und einfacher ist, ein Bicarbonatsalz (NaHCO) direkt zu verwenden3, beispielsweise).
Risiken
Kohlensäure hat unter normalen Bedingungen eine so geringe Lebensdauer (sie schätzt etwa 300 Nanosekunden), dass sie für die Umwelt und die Lebewesen praktisch harmlos ist. Wie bereits erwähnt, bedeutet dies jedoch nicht, dass der pH-Wert des Meerwassers nicht besorgniserregend verändert werden kann, was sich auf die Meeresfauna auswirkt..
Andererseits besteht das wirkliche „Risiko“ in der Aufnahme von kohlensäurehaltigem Wasser, da die Menge an COzwei in ihnen gelöst ist viel höher als in normalem Wasser. Es gibt jedoch auch keine Studien, die gezeigt haben, dass das Trinken von kohlensäurehaltigem Wasser ein lebensbedrohliches Risiko darstellt. wenn sie es sogar empfehlen, um zu fasten und Verdauungsstörungen zu bekämpfen.
Der einzige negative Effekt, der bei denen beobachtet wird, die dieses Wasser trinken, ist das Gefühl der Fülle, wenn sich ihr Magen mit Gasen füllt. Abgesehen davon (ganz zu schweigen von Limonaden, da sie viel mehr als nur Kohlensäure enthalten) kann man sagen, dass diese Verbindung überhaupt nicht toxisch ist.
Verweise
- Day, R. & Underwood, A. (1989). Quantitative Analytical Chemistry (fünfte Ausgabe). PEARSON Prentice Hall.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Kohlensäure. Wiederhergestellt von: en.wikipedia.org
- Danielle Reid. (2019). Kohlensäure: Video zur Bildung, Struktur und chemischen Gleichung. Studie. Wiederhergestellt von: study.com
- Götz Bucher & Wolfram Sander. (2014). Klärung der Struktur von Kohlensäure. Vol. 346, Issue 6209, pp. 544-545. DOI: 10.1126 / science.1260117
- Lynn Yarris. (22. Oktober 2014). Neue Erkenntnisse über Kohlensäure in Wasser. Berkeley Lab. Wiederhergestellt von: newscenter.lbl.gov
- Claudia Hammond. (2015, 14. September). Ist Sprudelwasser wirklich schlecht für dich? Wiederhergestellt von: bbc.com
- Jürgen Bernard. (2014). Feste und gasförmige Kohlensäure. Institut für Physikalische Chemie. Universität Innsbruck.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.