
Fibronektinstruktur und -funktionen

Das Fibronektin Es ist eine Klasse von Glykoproteinen, die zur extrazellulären Matrix gehört. Diese Art von Protein ist im Allgemeinen für die Anlagerung oder Bindung der Zellmembran an die Kollagenfasern verantwortlich, die sich außen befinden.
Der Name "Fibronektin" kommt von einem Wort, das aus zwei lateinischen Wörtern besteht, wobei das erste "Ballaststoff" was bedeutet, Faser oder Filament und, die zweite "Necter" was bedeutet, zu verbinden, zu verknüpfen, einzufügen oder zu binden.
Fibronektin wurde erstmals 1948 als Verunreinigung von Fibrinogen sichtbar gemacht, das durch Cohns Kaltethanolfraktionierungsverfahren hergestellt wurde. Dies wurde als einzigartiges Plasmaglykoprotein identifiziert, das die Eigenschaften eines kaltunlöslichen Globulins besaß..
Dieses Protein hat ein hohes Molekulargewicht und wurde mit einer Vielzahl von Funktionen innerhalb von Geweben in Verbindung gebracht. Dazu gehören unter anderem die Adhäsion zwischen Zelle und Zelle, die Organisation des Zytoskeletts und die onkogene Transformation..
Fibronektin wird durch seine lösliche Form in Blutplasma, Liquor cerebrospinalis, Synovialflüssigkeit, Fruchtwasser, Samenflüssigkeit, Speichel und entzündlichen Exsudaten an vielen Stellen im Körper verteilt..
Forscher haben berichtet, dass die Plasmafibronektinkonzentrationen ansteigen, wenn schwangere Frauen an Präeklampsie leiden. Daher wurde diese Erhöhung der Fibronektinkonzentration von Spezialisten zur Diagnose dieses Zustands berücksichtigt..
Artikelverzeichnis
- 1 Struktur
- 1.1 Domänen und Eigenschaften "Mehrfachhaftung"
- 2 Funktionen
- 3 Referenzen
Struktur
Fibronektine sind große Glykoproteine mit einem Molekulargewicht von ca. 440 kDa. Sie bestehen aus etwa 2.300 Aminosäuren, die 95% des Proteins ausmachen, da die anderen 5% Kohlenhydrate sind.
Die verschiedenen Analysen, die an der genomischen und transkriptomischen Sequenz (Messenger-RNA) des Proteins durchgeführt wurden, haben gezeigt, dass es aus drei Blöcken wiederholter homologer Sequenzen mit Längen von jeweils 45, 60 und 90 Aminosäuren besteht..
Die drei Arten von Sequenzen machen mehr als 90% der Gesamtstruktur von Fibronektinen aus. Homologe Sequenzen vom Typ I und II sind Schleifen, die durch Disulfidbrücken miteinander verbunden sind. Diese Schleifen enthalten jeweils 45 bzw. 60 Aminosäurereste..
Homologe Typ III-Sequenzen entsprechen 90 Aminosäuren, die linear und ohne interne Disulfidbrücken angeordnet sind. Einige der internen Aminosäuren homologer Typ III-Sequenzen weisen jedoch freie sulfhydrische Gruppen (R-S-H) auf..
Die drei homologen Sequenzen falten sich und organisieren sich in einer mehr oder weniger linearen Matrix, um zwei "dimere Arme" nahezu identischer Proteinuntereinheiten zu bilden. Unterschiede zwischen den beiden Untereinheiten ergeben sich aus posttranskriptionellen Reifungsereignissen.
Fibronektine können im Allgemeinen auf zwei Arten gesehen werden. Eine offene Form, die beobachtet wird, wenn sie sich auf der Oberfläche der Membran ablagern und bereit sind, sich mit einer anderen Komponente der Zellaußenseite zu verbinden. Diese Form wird nur durch Elektronenmikroskopie gesehen..
Die andere Form kann in physiologischen Lösungen gesehen werden. Die Enden jedes Arms oder jeder Verlängerung sind zur Mitte des Proteins hin gefaltet und verbinden sich durch die Carboxylenden der Kollagenbindungsstellen. In dieser Form hat das Protein ein kugelförmiges Aussehen.
"Multi-Adhäsions" -Domänen und -Eigenschaften
Die Mehrfachadhäsionseigenschaften von Fibronektin beruhen auf dem Vorhandensein verschiedener Domänen, die hohe Affinitätswerte für verschiedene Substrate und Proteine aufweisen..
Die "dimeren Arme" können in 7 verschiedene funktionelle Domänen unterteilt werden. Diese werden nach dem Substrat oder der Domäne klassifiziert, an die jeder bindet. Zum Beispiel: Domäne 1 und Domäne 8 sind Fibrinprotein-Bindungsdomänen.
Domäne 2 hat Kollagenbindungseigenschaften, Domäne 6 ist eine Zelladhäsionsregion, dh sie ermöglicht es ihr, sich auf nahezu jeder Membran oder äußeren Oberfläche von Zellen zu verankern. Die Funktionen der Domänen 3 und 5 sind bis heute unbekannt.
In Domäne 9 befindet sich das Carboxylende oder das C-terminale Ende des Proteins. Die Zelladhäsionsregionen der Domäne 6 besitzen das Tripeptid, das aus der Aminosäuresequenz Arginin-Glycin-Asparagin (Arg-Gly-Asp) besteht..
Dieses Tripeptid wird von mehreren Proteinen wie Kollagen und Integrinen geteilt. Dies ist die Mindeststruktur, die für die Erkennung der Plasmamembran durch Fibronektine und Integrine erforderlich ist..
Fibronektin stellt in seiner Kugelform eine lösliche und freie Form im Blut dar. Auf Zelloberflächen und in der extrazellulären Matrix befindet es sich jedoch in einer „offenen“, starren und unlöslichen Form..
Eigenschaften
Einige der Prozesse, bei denen die Beteiligung von Fibronektinen auffällt, sind die Anlagerung von Zelle zu Zelle, die Anlagerung von Zellen, die Verbindung oder Anhaftung an Plasma- oder Basalmembranen, die Stabilisierung von Blutgerinnseln und die Wundheilung..
Zellen haften an einer spezifischen Stelle auf Fibronektin durch ein Rezeptorprotein, das als "Integrin" bekannt ist. Dieses Protein passiert die Plasmamembran im Inneren der Zelle.
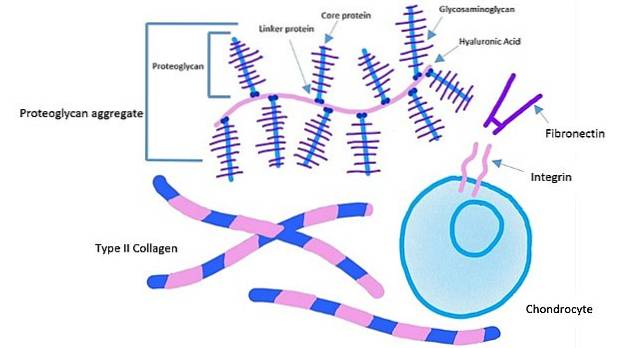
Die extrazelluläre Domäne von Integrinen bindet an Fibronektin, während die intrazelluläre Domäne von Integrinen an Aktinfilamente gebunden ist. Diese Art der Verankerung ermöglicht es, die in der extrazellulären Matrix erzeugte Spannung auf das Zytoskelett der Zellen zu übertragen..
Fibronektine sind am Wundheilungsprozess beteiligt. Diese lagern sich in ihrer löslichen Form auf den Kollagenfasern neben der Wunde ab und unterstützen so die Migration von Phagozyten, Fibroblasten und die Zellproliferation in der offenen Wunde..
Der eigentliche Heilungsprozess beginnt, wenn Fibroblasten das Fibronektin-Netzwerk "spinnen". Dieses Netzwerk fungiert als eine Art Gerüst oder Träger für die Ablagerung der neuen Kollagenfasern, Heparansulfat, Proteoglycan, Chondrotinsultafo und der anderen Komponenten der extrazellulären Matrix, die zur Reparatur des Gewebes erforderlich sind..
Fibronektin ist auch an der Bewegung von Epidermiszellen beteiligt, da es durch das körnige Gewebe hilft, die unter der Epidermis im Gewebe liegende Basalmembran zu reorganisieren, was zur Keratinisierung beiträgt..
Alle Fibronektine haben wesentliche Funktionen für alle Zellen; Beteiligen Sie sich an so unterschiedlichen Prozessen wie Zellmigration und -differenzierung, Homöostase, Wundheilung und Phagozytose.
Verweise
- A. Conde-Agudelo, R. Romero & J. M. Roberts (2015). Tests zur Vorhersage der Präeklampsie. Bei Chesleys hypertensiven Störungen in der Schwangerschaft (S. 221-251). Akademische Presse.
- Farfán, J. Á. L., Tovar, H.B.S., de Anda, M.D.R.G. & Guevara, C.G. (2011). Fötales Fibronektin und zervikale Länge als frühe Prädiktoren für eine Frühgeburt. Gynäkologie und Geburtshilfe von Mexiko, 79 (06), 337-343.
- Feist, E. & Hiepe, F. (2014). Fibronektin-Autoantikörper. In Autoantikörpern (S. 327-331). Elsevier.
- Letourneau, P. (2009). Axonale Wegfindung: Extrazelluläre Matrixrolle. Encyclopedia of Neuroscience, 1, 1139–1145.
- Pankov, R. & Yamada, K. M. (2002). Fibronektin auf einen Blick. Journal of Cell Science, 115 (20), 3861 & ndash; 3863.
- Proctor, R. A. (1987). Fibronektin: Ein kurzer Überblick über seine Struktur, Funktion und Physiologie. Übersichten über Infektionskrankheiten, 9 (Supplement_4), S317-S321.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.