
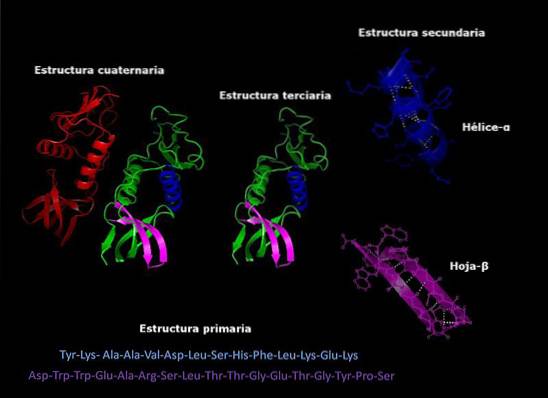
Primärstruktur charakteristischer Proteine
Das Primärstruktur von Proteinen Es ist die Reihenfolge, in der die Aminosäuren des Polypeptids oder der Polypeptide, aus denen sie bestehen, angeordnet sind. Ein Protein ist ein Biopolymer, das aus α-Aminosäuremonomeren besteht, die durch Peptidbindungen verbunden sind. Jedes Protein hat eine definierte Sequenz dieser Aminosäuren.
Proteine erfüllen eine Vielzahl biologischer Funktionen, einschließlich der Formung und Aufrechterhaltung der Integrität von Zellen durch das Zytoskelett, der Abwehr des Körpers vor Fremdstoffen durch Antikörper und der Katalyse chemischer Reaktionen im Körper durch Enzyme..
Die Bestimmung der Zusammensetzung von Proteinen und der Reihenfolge, in der Aminosäuren angeordnet sind (Sequenzierung), ist heute schneller als vor Jahren. Diese Informationen werden in internationalen elektronischen Datenbanken hinterlegt, auf die über das Internet zugegriffen werden kann (ua GenBank, PIR)..
Artikelverzeichnis
- 1 Aminosäuren
- 1.1 Aliphatische Aminosäuren
- 1.2 Aminosäuren mit Seitenketten, die Hydroxyl oder Schwefel enthalten
- 1.3 Cyclische Aminosäuren
- 1.4 Aromatische Aminosäuren
- 1.5 Basische Aminosäuren
- 1.6 Saure Aminosäuren und ihre Amide
- 2 Peptidbindungen
- 3 Aminosäuresequenz
- 4 Kodierung von Proteinen
- 5 Referenzen
Aminosäuren
Aminosäuren sind Moleküle, die eine Aminogruppe und eine Carbonsäuregruppe enthalten. Im Fall von α-Aminosäuren haben sie ein zentrales Kohlenstoffatom (α-Kohlenstoff), an das sowohl die Aminogruppe als auch die Carboxylgruppe gebunden sind, sowie ein Wasserstoffatom und eine charakteristische R-Gruppe, die als Seitenkette bezeichnet wird.
Aufgrund dieser Konfiguration des α-Kohlenstoffs sind die gebildeten Aminosäuren, die als α-Aminosäuren bekannt sind, chiral. Es entstehen zwei Formen, die spiegelbildlich zueinander sind und als L- und D-Enantiomere bezeichnet werden..
Alle Proteine in Lebewesen bestehen aus 20 α-Aminosäuren der L-Konfiguration. Die Seitenketten dieser 20 Aminosäuren sind unterschiedlich und weisen eine große Vielfalt chemischer Gruppen auf.
Grundsätzlich können α-Aminosäuren in Abhängigkeit von der Art der Seitenkette wie folgt (willkürlich) gruppiert werden.
Aliphatische Aminosäuren
In dieser Gruppe sind nach Angaben einiger Autoren Glycin (Gli), Alanin (Ala), Valin (Val), Leucin (Leu) und Isoleucin (Ile) enthalten. Andere Autoren sind auch Methionin (Met) und Prolin (Pro).
Aminosäuren mit hydroxyl- oder schwefelhaltigen Seitenketten
Enthält Serin (Ser), Cystein (Cys), Threonin (Thr) und auch Methionin. Laut einigen Autoren sollte die Gruppe nur Ser und Thr umfassen.
Cyclische Aminosäuren
Besteht ausschließlich aus Prolin, das, wie bereits erwähnt, von anderen Autoren zu den aliphatischen Aminosäuren gehört.
Aromatische Aminosäuren
Phenylalanin (Phe), Tyrosin (Tyr) und Tryptophan (Trp).
Basische Aminosäuren
Histidin (His), Lysin (Lys) und Arginin (Arg)
Saure Aminosäuren und ihre Amide
Es enthält Asparaginsäure (Asp) und Glutaminsäure (Glu) sowie die Amide Aspargin (Asn) und Glutamin (Gln). Einige Autoren trennen diese letzte Gruppe in zwei Teile; einerseits die von sauren Aminosäuren (die ersten beiden) und andererseits diejenigen, die Carboxylamid enthalten (die verbleibenden zwei).
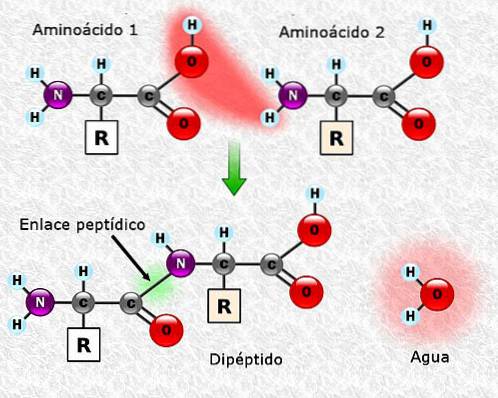
Peptidbindungen
Aminosäuren können über Peptidbindungen miteinander verbunden werden. Diese Bindungen, auch Amidbindungen genannt, werden zwischen der α-Aminogruppe einer Aminosäure und der α-Carboxylgruppe einer anderen hergestellt. Diese Vereinigung entsteht mit dem Verlust eines Wassermoleküls.
Die Vereinigung zwischen zwei Aminosäuren führt zur Bildung eines Dipeptids, und wenn neue Aminosäuren hinzugefügt werden, könnten Tripeptide, Tetrapeptide usw. nacheinander gebildet werden.
Polypeptide, die aus einer kleinen Anzahl von Aminosäuren bestehen, werden im Allgemeinen als Oligopeptide bezeichnet, und wenn die Anzahl der Aminosäuren hoch ist, werden sie als Polypeptide bezeichnet..
Jede Aminosäure, die der Polypeptidkette hinzugefügt wird, setzt ein Wassermolekül frei. Der Teil der Aminosäure, der während der Vereinigung das H + oder OH- verloren hat, wird als Aminosäurerest bezeichnet.
Die meisten dieser Oligopeptid- und Polypeptidketten weisen an einem Ende eine aminoterminale Gruppe (N-terminal) und am anderen Ende ein terminales Carboxyl (C-terminal) auf. Zusätzlich können sie viele ionisierbare Gruppen zwischen den Seitenketten der Aminosäurereste enthalten, aus denen sie bestehen. Aus diesem Grund werden sie als Polyampolithen betrachtet.
Aminosäuresequenz
Jedes Protein hat eine bestimmte Sequenz seiner Aminosäurereste. Diese Reihenfolge ist als Primärstruktur des Proteins bekannt..
Jedes einzelne Protein in jedem Organismus ist speziesspezifisch. Das heißt, das Myoglobin eines Menschen ist identisch mit dem eines anderen Menschen, es weist jedoch kleine Unterschiede zu den Myoglobinen anderer Säugetiere auf..
Die Menge und Art der Aminosäuren, die ein Protein enthält, ist ebenso wichtig wie die Position dieser Aminosäuren innerhalb der Polypeptidkette. Um Proteine zu verstehen, müssen Biochemiker zuerst jedes einzelne Protein isolieren und reinigen, dann eine Analyse des Aminosäuregehalts durchführen und schließlich seine Sequenz bestimmen..
Zur Isolierung und Reinigung von Proteinen gibt es verschiedene Methoden, darunter: Zentrifugation, Chromatographie, Gelfiltration, Dialyse und Ultrafiltration sowie die Verwendung der Löslichkeitseigenschaften des untersuchten Proteins..
Die Bestimmung der in Proteinen vorhandenen Aminosäuren erfolgt in drei Schritten. Die erste besteht darin, Peptidbindungen durch Hydrolyse aufzubrechen. Anschließend werden die verschiedenen Arten von Aminosäuren in der Mischung getrennt; und schließlich wird jede der erhaltenen Arten von Aminosäuren quantifiziert.
Um die Primärstruktur des Proteins zu bestimmen, können verschiedene Methoden verwendet werden; Derzeit wird jedoch am häufigsten die Edman-Methode verwendet, die im Wesentlichen darin besteht, die N-terminale Aminosäure wiederholt zu markieren und vom Rest der Kette zu trennen und jede einzeln freigesetzte Aminosäure zu identifizieren.
Proteinkodierung
Die Primärstruktur von Proteinen ist in den Genen von Organismen kodiert. Genetische Informationen sind in der DNA enthalten, müssen jedoch für ihre Translation in Proteine zunächst in mRNA-Moleküle transkribiert werden. Jedes Nukleotidtriplett (Codon) kodiert für eine Aminosäure.
Da es 64 mögliche Codons gibt und nur 20 Aminosäuren bei der Konstruktion von Proteinen verwendet werden, kann jede Aminosäure von mehr als einem Codon codiert werden. Praktisch alle Lebewesen verwenden dieselben Codons, um dieselben Aminosäuren zu codieren. Daher wird der genetische Code als eine fast universelle Sprache angesehen.
In diesem Code werden Codons verwendet, um die Translation des Polypeptids zu starten und auch zu stoppen. Die Stopcodons codieren keine Aminosäure, sondern stoppen die Translation am C-Terminus der Kette und werden durch die Tripletts UAA, UAG und UGA dargestellt..
Andererseits fungiert das AUG-Codon normalerweise als Startsignal und codiert auch für Methionin..
Nach der Translation können Proteine einer gewissen Verarbeitung oder Modifikation unterzogen werden, beispielsweise einer Verkürzung durch Fragmentierung, um ihre endgültige Konfiguration zu erreichen.
Verweise
- C.K. Mathews, K.E. van Holde & K.G. Ahern. 2002. Biochemestry. 3th Auflage. Benjamin / Cummings Publishing Company, Inc..
- Murray, P. Mayes, D.C. Granner & V.W. Rodwell. 1996. Harper's Biochemestry. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & L. Stryer (nd). Biochemie. 5th Auflage. W. H. Freeman und Company.
- J. Koolman & K.-H. Roehm (2005). Farbatlas der Biochemie. zweind Auflage. Thieme.
- A. Lehninger (1978). Biochemie. Ediciones Omega, S.A..
- L. Stryer (1995). Biochemie. W.H. Freeman and Company, New York.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.