
Alkineigenschaften, Struktur, Verwendung und Beispiele
Das Alkine Sie sind Kohlenwasserstoffe oder organische Verbindungen, die in ihren Strukturen eine Dreifachbindung zwischen zwei Kohlenstoffen aufweisen. Diese Dreifachbindung (≡) wird als funktionelle Gruppe angesehen, da sie ein aktives Zentrum des Moleküls darstellt und daher für deren Reaktivität verantwortlich ist.
Obwohl sich Alkine nicht sehr von Alkanen oder Alkenen unterscheiden, weisen sie aufgrund der Art ihrer Bindungen eine größere Azidität und Polarität auf. Der genaue Begriff, um diesen kleinen Unterschied zu beschreiben, ist als bekannt Ungesättigtheit.

Alkane sind gesättigte Kohlenwasserstoffe, während Alkine in Bezug auf die ursprüngliche Struktur am ungesättigtsten sind. Was bedeutet das? Dass ein Alkan H.3C-CH3 (Ethan) kann zu H dehydriert werdenzweiC = CHzwei (Ethen) und später zu HC≡CH (Ethin oder besser bekannt als Acetylen).
Es ist zu beachten, dass die Anzahl der an sie gebundenen Wasserstoffatome abnimmt, wenn zusätzliche Bindungen zwischen den Kohlenstoffen gebildet werden. Kohlenstoff versucht aufgrund seiner elektronischen Eigenschaften, vier einfache Bindungen zu bilden. Je höher die Ungesättigtheit, desto größer die Reaktionstendenz (mit Ausnahme von aromatischen Verbindungen)..
Andererseits ist die Dreifachbindung viel stärker als die Doppelbindung (=) oder die Einfachbindung (-), jedoch mit hohen Energiekosten. Daher können die meisten Kohlenwasserstoffe (Alkane und Alkene) bei erhöhten Temperaturen Dreifachbindungen bilden..
Infolge der hohen Energien dieser und wenn sie brechen, geben sie viel Wärme ab. Ein Beispiel für dieses Phänomen ist, wenn Acetylen mit Sauerstoff verbrannt wird und die intensive Hitze der Flamme zum Schweißen oder Schmelzen von Metallen verwendet wird (oberes Bild)..
Acetylen ist das einfachste und kleinste Alkin von allen. Andere Kohlenwasserstoffe können aus ihrer chemischen Formel ausgedrückt werden, indem Alkylgruppen (RC≡CR ') durch H ersetzt werden. Das gleiche passiert in der Welt der organischen Synthese durch eine Vielzahl von Reaktionen.
Dieses Alkin entsteht aus der Reaktion von Calciumoxid aus Kalkstein und Koks, einem Rohstoff, der die notwendigen Kohlenstoffe in einem Elektroofen liefert:
CaO + 3C => CaCzwei + CO
Das CaCzwei Es ist Calciumcarbid, eine anorganische Verbindung, die schließlich mit Wasser unter Bildung von Acetylen reagiert:
CaCzwei + 2HzweiO => Ca (OH)zwei + HC≡CH
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften von Alkinen
- 1.1 Polarität
- 1.2 Säure
- 2 Reaktivität
- 2.1 Hydrierung
- 2.2 Zugabe von Halogenwasserstoffen
- 2.3 Flüssigkeitszufuhr
- 2.4 Zugabe von Halogenen
- 2.5 Alkylierung von Acetylen
- 3 Chemische Struktur
- 3.1 Abstand der Verbindungen und terminalen Alkine
- 4 Nomenklatur
- 5 Verwendungen
- 5.1 Acetylen oder Ethin
- 5.2 Natürliche Alkine
- 6 Beispiele für Alkine
- 6.1 Tarirsäure
- 6.2 Histrionicotoxin
- 6.3 Cicutoxin
- 6.4 Capillin
- 6.5 Pargyline
- 7 Referenzen
Physikalische und chemische Eigenschaften von Alkinen
Polarität
Die Dreifachbindung unterscheidet Alkine von Alkanen und Alkenen. Die drei Arten von Kohlenwasserstoffen sind unpolar, wasserunlöslich und sehr schwache Säuren. Die Elektronegativität der Doppel- und Dreifachbindungskohlenstoffe ist jedoch größer als die der Einzelkohlenstoffe..
Dementsprechend ergeben die an die Dreifachbindung angrenzenden Kohlenstoffe durch induktiven Effekt eine negative Ladungsdichte. Aus diesem Grund gibt es bei C≡C- oder C = C-Bindungen eine höhere Elektronendichte als im Rest des Kohlenstoffgerüsts. Infolgedessen gibt es ein kleines Dipolmoment, bei dem die Moleküle durch Dipol-Dipol-Kräfte interagieren..
Diese Wechselwirkungen sind sehr schwach, wenn ihre Dipolmomente mit denen des Wassermoleküls oder eines Alkohols verglichen werden. Dies spiegelt sich in ihren physikalischen Eigenschaften wider: Alkine haben im Allgemeinen höhere Schmelz- und Siedepunkte als ihre weniger ungesättigten Kohlenwasserstoffe..
Ebenso sind sie aufgrund ihrer geringen Polarität in Wasser weniger unlöslich, aber in unpolaren organischen Lösungsmitteln wie Benzol löslich..
Säure
Diese Elektronegativität verursacht auch Wasserstoff HC≡CR ist saurer als alle anderen Kohlenwasserstoffe. Daher sind Alkine saurer als Alkene und viel saurer als Alkane. Sein Säuregehalt ist jedoch im Vergleich zu dem von Carbonsäuren immer noch vernachlässigbar..
Da Alkine sehr schwache Säuren sind, reagieren sie nur mit sehr starken Basen wie Natriumamid:
HC≡CR + NaNHzwei => HC≡CNa + NH3
Aus dieser Reaktion wird eine Lösung von Natriumacetylid erhalten, ein Rohmaterial für die Synthese anderer Alkine..
Reaktivität
Die Reaktivität von Alkinen wird durch die Addition kleiner Moleküle an ihre Dreifachbindung erklärt, wodurch deren Ungesättigtheit verringert wird. Dies können durchaus Wasserstoffmoleküle, Halogenwasserstoffe, Wasser oder Halogene sein..
Hydrierung
Das kleine Molekül von H.zwei Es ist sehr schwer fassbar und schnell. Um die Wahrscheinlichkeit zu erhöhen, dass sie zur Dreifachbindung von Alkinen hinzugefügt werden, müssen Katalysatoren verwendet werden.
Dies sind normalerweise Metalle (Pd, Pt, Rh oder Ni), die fein verteilt sind, um die Oberfläche zu vergrößern. und damit der Kontakt zwischen Wasserstoff und Alkin:
RC≡CR '+ 2Hzwei => RCHzweiCHzweiR '
Das Ergebnis ist, dass der Wasserstoff an den Kohlenstoffen "verankert" ist, die eine Bindung aufbrechen, und so weiter, bis das entsprechende Alkan RCH erzeugt wirdzweiCHzweiR '. Dies sättigt nicht nur den anfänglichen Kohlenwasserstoff, sondern verändert auch seine Molekülstruktur..
Zugabe von Halogenwasserstoffen
Hier wird das anorganische Molekül HX hinzugefügt, wobei X eines der Halogene (F, Cl, Br oder I) sein kann:
RC≡CR '+ HX => RCH = CXR'
Flüssigkeitszufuhr
Die Hydratisierung von Alkinen erfolgt, wenn sie ein Wassermolekül unter Bildung eines Aldehyds oder eines Ketons hinzufügen:
RC≡CR '+ H.zweiO => RCHzweiCOR '
Wenn R 'ein H ist, ist es ein Aldehyd; Wenn es ein Alkyl ist, dann ist es ein Keton. Bei der Reaktion wird eine als Enol bekannte Verbindung (RCH = C (OH) R ') als Zwischenprodukt gebildet..
Dies wird in einem als Tautomerisierung bezeichneten Gleichgewicht von der Enolform (C-OH) in die ketonische Form (C = O) umgewandelt.
Zugabe von Halogenen
Und in Bezug auf Additionen sind die zweiatomigen Moleküle der Halogene (X.zwei= F.zwei, Clzwei, Brzwei Ich hörtezwei):
RC≡CR '+ 2Xzwei => RCXzwei-CXzweiR '
Acetylenalkylierung
Andere Alkine können aus der Natriumacetylidlösung unter Verwendung eines Alkylhalogenids hergestellt werden:
HC≡CNa + RX => HC≡CR + NaX
Wenn es beispielsweise Methyliodid wäre, wäre das resultierende Alkin:
HC≡CNa + CH3I => HC≡CCH3 + NaX
HC≡CCH3 ist die Spitze, auch bekannt als MethylAcetylen.
Chemische Struktur
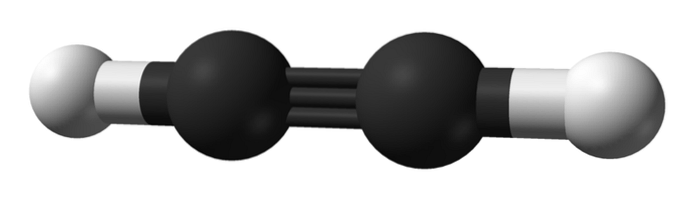
Wie ist die Struktur von Alkinen? Ein Acetylenmolekül ist im oberen Bild dargestellt. Daraus kann die lineare Geometrie der Bindung C enlaceC deutlich beobachtet werden.
Daher sollte bei einer Dreifachbindung die Struktur des Moleküls linear sein. Dies ist ein weiterer bemerkenswerter Unterschied zwischen ihnen und dem Rest der Kohlenwasserstoffe.
Alkane werden üblicherweise als Zickzack dargestellt, da sie eine sp-Hybridisierung aufweisen3 und ihre Verbindungen sind 109º voneinander entfernt. Sie sind tatsächlich eine Kette von kovalent verknüpften Tetraedern. Während die Alkene durch sp-Hybridisierung flach sindzwei von seinen Kohlenstoffen, genauer gesagt, eine trigonale Ebene mit durch 120º getrennten Bindungen bildend.
In Alkinen ist die Orbitalhybridisierung sp, dh sie haben 50% s-Charakter und 50% p-Charakter. Es gibt zwei hybride sp-Orbitale, die an H-Atome in Acetylen oder an Alkylgruppen in Alkinen binden..
Der Abstand zwischen den beiden H oder R beträgt 180º, zusätzlich zu der Tatsache, dass nur auf diese Weise die reinen p-Orbitale der Kohlenstoffe die Dreifachbindung bilden können. Aus diesem Grund ist die Bindung -C≡C- linear. Bei Betrachtung der Struktur eines Moleküls fällt das -C≡C- in den Regionen auf, in denen das Skelett sehr linear ist.
Entfernung der Verbindungen und terminalen Alkine
Die Kohlenstoffe in der Dreifachbindung sind näher beieinander als in der Doppel- oder Einfachbindung. Mit anderen Worten ist C≡C kürzer als C = C und C-C. Infolgedessen ist die Bindung stärker, da die beiden π-Bindungen zur Stabilisierung der einzelnen σ-Bindung beitragen..
Befindet sich die Dreifachbindung am Ende einer Kette, handelt es sich um ein terminales Alkin. Daher muss die Formel dieser Verbindung HC≡CR sein, wobei H das Ende oder den Anfang der Kette hervorhebt.
Wenn es sich im Gegenteil um eine interne Dreifachbindung handelt, lautet die Formel RC≡CR ', wobei R und R' die rechte und linke Seite der Kette sind.
Nomenklatur
Wie werden Alkine nach den von der IUPAC vorgeschriebenen Regeln benannt? Ebenso wie Alkane und Alkene benannt wurden. Dazu wird das Suffix -ano oder -eno in das Suffix -ino geändert.
Zum Beispiel: der HC≡CCH3 es heißt Propin, da es drei Kohlenstoffe wie Propan (CH) enthält3CHzweiCH3). Der HC≡CCHzweiCH3 ist 1-Butin, das ein terminales Alkin ist. Aber im Fall der CH3C≡CCH3 es ist 2-Butin, und dabei ist die Dreifachbindung nicht terminal, sondern intern.
Das CH3C≡CCHzweiCHzwei(CH3)zwei ist 5-Methyl-2-hexin. Die Kohlenstoffe werden von der Seite gezählt, die der Dreifachbindung am nächsten liegt.
Eine andere Art von Alkinen sind Cycloalkine. Für sie reicht es aus, das Suffix -ano durch -ino des entsprechenden Cycloalkans zu ersetzen. Daher wird das Cyclopropan, das eine Dreifachbindung aufweist, als Cyclopropino bezeichnet (das nicht existiert)..
Bei zwei Dreifachbindungen wird das Präfix di- zum Namen hinzugefügt. Beispiele sind HC≡C-C≡H, Diacetylen oder Propadino; und zu HC≡C-C-C≡H, Butadiino.
Anwendungen
Acetylen oder Ethin
Das kleinste der Alkine verdickt die mögliche Anzahl von Verwendungen für diese Kohlenwasserstoffe. Daraus können durch Alkylierungen andere organische Verbindungen synthetisiert werden. Ebenso unterliegt es oxidativen Reaktionen, um unter anderem Ethanol, Essigsäure und Acrylsäure zu erhalten..
Eine andere Verwendung besteht darin, die Wärmequelle bereitzustellen, um die Elektronen der Atome anzuregen; Insbesondere von Metallkationen bei der Bestimmung der Atomabsorption und -emission, einer weit verbreiteten spektroskopischen Technik.
Natürliche Alkine
Die einzigen existierenden Verfahren zur Herstellung von Alkinen sind nicht nur synthetisch oder unter Anwendung von Wärme in Abwesenheit von Sauerstoff, sondern auch biologisch.
Diese verwenden sogenannte Enzyme Acetylenasen, die eine Doppelbindung dehydrieren kann. Dank dessen werden viele natürliche Alkinquellen gewonnen.
Infolgedessen können Gifte, Gegenmittel, Arzneimittel oder andere Verbindungen, die einen gewissen Nutzen bieten, aus diesen Quellen extrahiert werden. besonders wenn es um Gesundheit geht. Es gibt viele Alternativen, wenn sie ihre ursprünglichen Strukturen modifizieren und sie als Unterstützung für neue Alkine verwenden..
Beispiele für Alkine
Bisher wurden zahlreiche Beispiele für Alkine erwähnt. Einige stammen jedoch aus sehr spezifischen Quellen oder haben bestimmte molekulare Strukturen: Sie sind Polyacetylene.
Dies bedeutet, dass es mehr als eine Dreifachbindung geben kann, die Teil einer sehr großen Struktur ist, und nicht nur eine einfache Kohlenstoffkette..
Tarirsäure

Tarirsäure stammt aus einer in Guatemala gelegenen Pflanze namens Picramnia tariri. Es wird speziell aus dem Öl seiner Samen gewonnen.
In seiner Molekülstruktur kann eine einfache Dreifachbindung beobachtet werden, die einen unpolaren Schwanz von einem polaren Kopf trennt; Daher könnte es als amphipathisches Molekül angesehen werden.
Histrionicotoxin
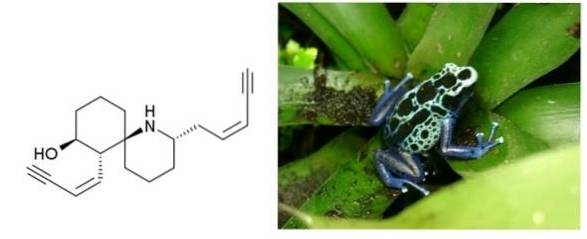
bei en.wikipedia [Public Domain], von Wikimedia Commons
Histrionicotoxin ist ein Gift, das von der Haut von Fröschen in Kolumbien, Brasilien und anderen lateinamerikanischen Ländern ausgeschieden wird. Es hat zwei Dreifachbindungen, die an eine Doppelbindung konjugiert sind. Beide sind terminal und durch einen Sechs-Kohlenstoff-Ring und ein cyclisches Amin getrennt..
Cicutoxin
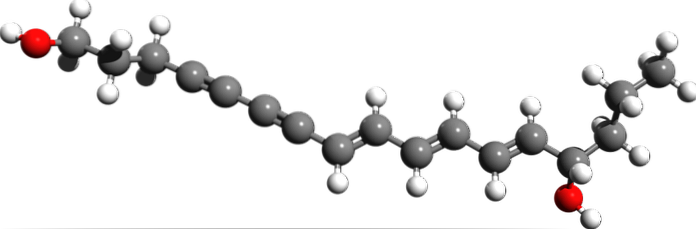
Wo liegen aus der Molekülstruktur von Cicutoxin die Dreifachbindungen? Wenn die Doppelbindungen wie rechts zu sehen flach sind und die Einfachbindungen wie an den Enden tetraedrisch sind, sind die Dreifachbindungen linear und befinden sich am Hang (\).
Diese Verbindung besteht aus einem Neurotoxin, das hauptsächlich in der aquatischen Hemlock-Pflanze vorkommt..
Capillina
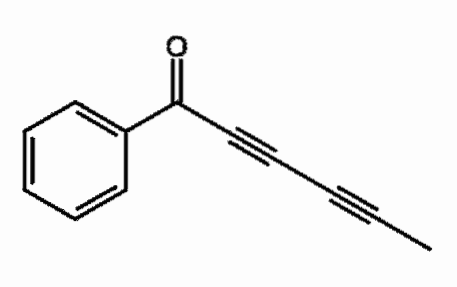
Es ist ein Alkin, das im ätherischen Öl von Beifußpflanzen enthalten ist und als Antimykotikum verwendet wird. Es können zwei aufeinanderfolgende Dreifachbindungen beobachtet werden, die genauer konjugiert sind.
Was bedeutet das? Diese Dreifachbindungen schwingen über die gesamte Kohlenstoffkette mit und beinhalten die Öffnung der C = O-Doppelbindung zu C-O-.
Pargyline
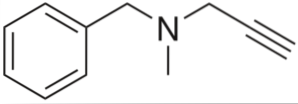
Es ist ein Alkin mit blutdrucksenkender Wirkung. Wenn wir seine Struktur nach Teilen analysieren, haben wir: eine Benzylgruppe links, ein tertiäres Amin in der Mitte und ein Propinyl rechts; das heißt, eine terminale Propingruppe.
Verweise
- Francis A. Carey. Organische Chemie. Carbonsäuren. (sechste Ausgabe, S. 368-397). Mc Graw Hill.
- Brennan, John. (10. März 2018). Beispiele für Alkine. Wissenschaft. Entnommen aus: sciencing.com
- BYJU'S. (2018). Dreifachbindung in Alkinen. Entnommen aus: byjus.com
- Enzyklopädie der Beispiele (2017). Alkine. Wiederhergestellt von: examples.co
- Kevin A. Boudreaux. Alkine. Entnommen aus: angelo.edu
- Robert C. Neuman, Jr. Alkenes und Alkynes. [PDF]. Entnommen aus: chem.ucr.edu



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.