
Eigenschaften, Typen und Funktionen biogenetischer Elemente

Sie heißen biogenetische Elemente diese Atome, aus denen lebende Materie besteht. Etymologisch kommt der Begriff von bio, was auf Griechisch "Leben" bedeutet; Y. Genesis, was "Herkunft" bedeutet. Von allen bekannten Elementen sind nur etwa dreißig unverzichtbar..
Auf der untersten Organisationsebene besteht Materie aus winzigen Teilchen, die Atome genannt werden. Jedes Atom besteht aus Protonen und Neutronen im Kern und einer Reihe von Elektronen um ihn herum. Diese Bestandteile definieren die Eigenschaften der Elemente.
Sie haben strukturelle Funktionen, sind die Grundbestandteile in biologischen Molekülen (Proteine, Kohlenhydrate, Lipide und Nukleinsäuren) oder liegen in ihrer ionischen Form vor und wirken als Elektrolyt. Sie haben auch spezifische Funktionen, wie die Förderung der Muskelkontraktion oder das Vorhandensein im aktiven Zentrum eines Enzyms.
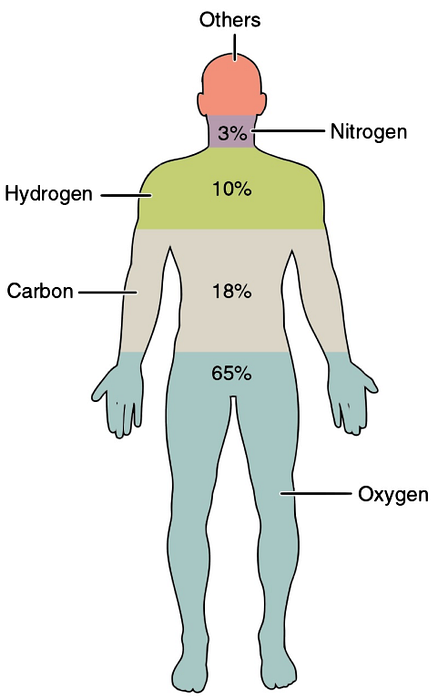
Alle biogenetischen Elemente sind essentiell, und wenn eines fehlen sollte, könnte das Phänomen des Lebens nicht auftreten. Die wichtigsten biogenetischen Elemente, die in lebender Materie am häufigsten vorkommen, sind Kohlenstoff, Wasserstoff, Stickstoff, Sauerstoff, Phosphor und Schwefel..
Artikelverzeichnis
- 1 Funktionen
- 1.1 Kovalente Bindungen
- 1.2 Fähigkeit zur Bildung von Einfach-, Doppel- und Dreifachbindungen
- 2 Klassifizierung
- 2.1 Primärelemente
- 2.2 Sekundärelemente
- 2.3 Spurenelemente
- 3 Funktionen
- 3.1 Kohlenstoff
- 3.2 Sauerstoff
- 3.3 Wasserstoff
- 3.4 Stickstoff
- 3.5 Phosphor
- 3.6 Schwefel
- 3.7 Calcium
- 3,8 Magnesium
- 3.9 Natrium und Kalium
- 3.10 Eisen
- 3.11 Fluor
- 3.12 Lithium
- 4 Referenzen
Eigenschaften
Biogenetische Elemente weisen eine Reihe chemischer Eigenschaften auf, die sie als Bestandteil lebender Systeme geeignet machen:
Kovalente Bindungen
Sie sind in der Lage, kovalente Bindungen zu bilden, bei denen die beiden Atome durch gemeinsame Nutzung von Elektronen aus ihrer Valenzschale verbunden werden. Wenn diese Bindung gebildet wird, befinden sich die gemeinsamen Elektronen im Kernraum.
Diese Bindungen sind ziemlich stark und stabil, ein Zustand, der in den Molekülen lebender Organismen vorhanden sein muss. Ebenso sind diese Bindungen nicht extrem schwer zu brechen, was es ermöglicht, ein gewisses Maß an Molekulardynamik herzustellen..
Fähigkeit zur Bildung von Einfach-, Doppel- und Dreifachbindungen
Dank der Fähigkeit, Einfach-, Doppel- und Dreifachbindungen zu bilden, kann eine signifikante Anzahl von Molekülen mit wenigen Elementen gebildet werden.
Diese Eigenschaft bietet nicht nur eine signifikante molekulare Vielfalt, sondern ermöglicht auch die Bildung von Strukturen mit unterschiedlichen Anordnungen (unter anderem linear, ringförmig)..
Einstufung
Biogenetische Elemente werden in Primär-, Sekundär- und Spurenelemente eingeteilt. Diese Anordnung basiert auf den unterschiedlichen Anteilen der Elemente in Lebewesen.
In den meisten Organismen bleiben diese Anteile erhalten, obwohl es bestimmte spezifische Variationen geben kann. Beispielsweise ist bei Wirbeltieren Jod ein entscheidendes Element, während es bei den anderen Wirbeltieren ein entscheidendes Element ist Taxa es scheint nicht der Fall zu sein.
Primärelemente
Das Trockengewicht der lebenden Materie besteht aus 95 bis 99% dieser chemischen Elemente. In dieser Gruppe finden wir die am häufigsten vorkommenden Elemente: Wasserstoff, Sauerstoff, Stickstoff und Kohlenstoff..
Diese Elemente können hervorragend mit anderen kombiniert werden. Darüber hinaus haben sie die Eigenschaft, mehrere Verbindungen zu bilden. Kohlenstoff kann bis zu Dreifachbindungen bilden und eine Vielzahl organischer Moleküle erzeugen.
Sekundäre Elemente
Die Elemente dieser Gruppe machen 0,7% bis 4,5% der lebenden Materie aus. Sie sind Natrium, Kalium, Kalzium, Magnesium, Chlor, Schwefel und Phosphor.
In Organismen finden sich sekundäre Elemente in ihrer ionischen Form; deshalb werden sie Elektrolyte genannt. Abhängig von ihrer Ladung können sie als Kationen (+) oder Anionen (-) klassifiziert werden.
Im Allgemeinen sind Elektrolyte an der osmotischen Regulation, am Nervenimpuls und am Transport von Biomolekülen beteiligt.
Osmotische Phänomene beziehen sich auf das ausreichende Gleichgewicht des Wassers innerhalb und außerhalb der Zellumgebung. Ebenso spielen sie eine Rolle bei der Aufrechterhaltung des pH-Werts in zellulären Umgebungen; sind als Puffer oder Pufferlösungen bekannt.
Spurenelemente
Sie sind in winzigen oder Spurenanteilen zu finden, die ungefähr weniger als 0,5% betragen. Das Vorhandensein in geringen Mengen bedeutet jedoch nicht, dass seine Rolle nicht wichtig ist. Tatsächlich sind sie für ein einwandfreies Funktionieren des lebenden Organismus ebenso wichtig wie die vorherigen Gruppen..
Diese Gruppe besteht aus Eisen, Magnesium, Kobalt, Kupfer, Zink, Molybdän, Jod und Fluor. Spurenelemente können wie die Gruppe der Sekundärelemente in ihrer ionischen Form vorliegen und Elektrolyte sein.
Eine seiner wichtigsten Eigenschaften ist es, in seinen verschiedenen Oxidationsstufen als stabiles Ion zu bleiben. Sie befinden sich in den aktiven Zentren von Enzymen (physikalischer Raum des Proteins, in dem die Reaktion stattfindet) oder wirken auf Moleküle, die Elektronen übertragen.
Andere Autoren neigen dazu, Bioelemente als essentiell und nicht essentiell zu klassifizieren. Die Klassifizierung nach ihrer Häufigkeit wird jedoch am häufigsten verwendet.
Eigenschaften
Jedes der biognesischen Elemente erfüllt eine wesentliche und spezifische Funktion im Körper. Unter den wichtigsten Funktionen können wir Folgendes erwähnen:
Kohlenstoff
Kohlenstoff ist der Hauptbaustein organischer Moleküle.
Sauerstoff
Sauerstoff spielt eine Rolle bei Atmungsprozessen und ist auch ein Hauptbestandteil der verschiedenen organischen Moleküle.
Wasserstoff
Es kommt im Wasser vor und ist Teil organischer Moleküle. Es ist sehr vielseitig, da es mit jedem anderen Element verknüpft werden kann.
Stickstoff
Gefunden in Proteinen, Nukleinsäuren und bestimmten Vitaminen.
Spiel
Phosphor ist in ATP (Adenosintriphosphat) enthalten, einem im Stoffwechsel weit verbreiteten Energiemolekül. Es ist die Energiewährung der Zellen.
Ebenso ist Phosphor Teil des genetischen Materials (DNA) und in bestimmten Vitaminen. Es kommt in Phospholipiden vor, entscheidenden Elementen für die Bildung biologischer Membranen.
Schwefel
Schwefel kommt in einigen Aminosäuren vor, insbesondere in Cystein und Methionin. Es ist in Coenzym A enthalten, einem Zwischenmolekül, das eine Vielzahl von Stoffwechselreaktionen ermöglicht.
Kalzium
Calcium ist wichtig für die Knochen. Muskelkontraktionsprozesse erfordern dieses Element. Muskelkontraktion und Blutgerinnung werden ebenfalls durch dieses Ion vermittelt.
Magnesium
Magnesium ist in Pflanzen besonders wichtig, da es im Chlorophyllmolekül vorkommt. Als Ion ist es als Cofaktor an verschiedenen Enzymwegen beteiligt.
Natrium und Kalium
Sie sind reichlich vorhandene Ionen im extrazellulären bzw. intrazellulären Medium. Diese Elektrolyte sind die Protagonisten des Nervenimpulses, da sie das Membranpotential bestimmen. Diese Ionen sind für die Natrium-Kalium-Pumpe bekannt.
Eisen
Es ist in Hämoglobin enthalten, einem Protein, das in Bluterythrozyten vorhanden ist und dessen Funktion der Sauerstofftransport ist.
Fluor
Fluorid ist in Zähnen und Knochen vorhanden.
Lithium
Lithium hat neurologische Funktionen.
Verweise
- Cerezo García, M. (2013). Grundlagen der Grundlagenbiologie. Publikationen der Universitat Jaume I..
- Galan, R. & Torronteras, S. (2015). Grundlagen- und Gesundheitsbiologie. Elsevier
- Gama, M. (2007). Biologie: ein konstruktivistischer Ansatz. Pearson Ausbildung.
- Macarulla, J. M. & Goñi, F. M. (1994). Humanbiochemie: Grundkurs. Rückgängig gemacht.
- Teijón, J. M. (2006). Grundlagen der Strukturbiochemie. Editorial Tébar.
- Urdiales, B.A.V., del Pilar Granillo, M. & Dominguez, M.D.S.V. (2000). Allgemeine Biologie: lebende Systeme. Grupo Editorial Patria.
- R. M. C. Vallespí, P. C. Ramírez, S. E. Santos, A. F. Morales, M. P. Torralba & D. S. Del Castillo (2013). Chemische Hauptverbindungen. Editorial UNED.
Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.