
Eigenschaften von Natriumdichromat (Na2Cr2O7), Herstellung, Verwendung

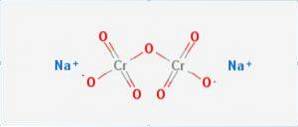
Das Natriumdichromat es ist eine anorganische Verbindung mit der Formel Na2Cr2O7. Es ist eine von vielen sechswertigen Chromverbindungen (Cr VI). Seine Struktur ist in Abbildung 1 dargestellt, obwohl das Salz normalerweise in seiner dihydratisierten Form gehandhabt wird, deren Formel Na2Cr2O7 · H2O wäre.
Es hat zwei Ionenbindungen zwischen Natriummolekülen und negativ geladenem Sauerstoff. Chromerz wird aus Natriumdichromat extrahiert. Jährlich werden Millionen Kilogramm Natriumdichromat produziert.
China ist der größte Produzent von Natriumdichromat. Chinesische Chemiefabriken haben jedoch eine relativ geringe Produktion von jeweils weniger als 50.000 Tonnen pro Jahr, verglichen mit dem kasachischen Werk, das mehr als 100.000 Tonnen pro Jahr produziert..
Pflanzen in Russland, den USA und Großbritannien haben eine Zwischenproduktion zwischen 50.000 und 100.000 Tonnen pro Jahr (Kogel, 2006).
In Bezug auf Reaktivität und Aussehen hat Natriumdichromat ähnliche Eigenschaften wie Kaliumdichromat, jedoch ist das Natriumsalz wasserlöslicher und hat ein geringeres Äquivalentgewicht als das Kaliumsalz..
Natriumdichromat erzeugt beim Erhitzen giftige Chromdämpfe. Es ist ein starkes Oxidationsmittel und stark ätzend.
Diese Verbindung kann in kontaminierten Trinkwasserquellen aus verschiedenen industriellen Prozessen wie Verzinkungs- oder Galvanisierungstechniken, Ledergerbung und Textilherstellung gefunden werden..
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften
- 2 Produktionsmethoden
- 3 Reaktivität und Gefahren
- 4 Verwendungen und Anwendungen
- 5 Biochemie
- 6 Referenzen
Physikalische und chemische Eigenschaften
Natriumdichromat besteht aus Kristallen mit einer monoklinen Struktur, die in ihrer wasserfreien und geruchlosen Form eine rot-orange Farbe haben. Sein Molekulargewicht beträgt in seiner wasserfreien Form 261,97 g / mol und in seiner Dihydratform 298,00 g / mol..
Es hat einen Schmelzpunkt von 356,7 Grad Celsius, einen Siedepunkt von 400 Grad Celsius, bei dem es sich zersetzt. Es hat eine Dichte von 2,52 g / ml.

Das Aussehen von Natriumdichromat ist in Abbildung 2 dargestellt. Seine Löslichkeit in Wasser beträgt 187 g pro 100 Gramm bei 25 Grad Celsius und seine Löslichkeit in Ethanol beträgt 513,2 Gramm pro Liter bei 19,4 Grad Celsius (Nationales Zentrum für Biotechnologie-Informationen, n. D.)..
Es gilt als stabile Verbindung, wenn es unter empfohlenen Bedingungen gelagert wird und nicht brennbar ist. Da es ein starkes Oxidationsmittel ist, ist es ätzend und in Lösung ist es Säure mit der Fähigkeit, den pH in einer 1% w / v Lösung auf 4 zu senken..
Produktionsmethoden
Natriumchromat kann durch einen kontinuierlichen Prozess, der sich mit Schwefelsäure, Kohlendioxid oder einer Kombination dieser beiden befasst, in Dichromat umgewandelt werden..
Das Verdampfen der Natriumdichromatflüssigkeit bewirkt die Ausfällung von Natriumsulfat und / oder Natriumbicarbonat, und diese Verbindungen werden vor der endgültigen Kristallisation von Natriumdichromat entfernt..
Natriumdichromat kann in einem dreistufigen Verfahren hergestellt werden:
- Oxidationsbedingungen für alkalischen Chromitbraten
- Auslaugen. Extraktion von löslichem Material aus einem Gemisch durch Einwirkung eines flüssigen Lösungsmittels
- Umwandlung von Natriummonochromat zu Natriumdichromat mittels einer Säure.
Wasserfreies Natriumdichromat kann hergestellt werden, indem Natriumdichromatdihydrat geschmolzen, wässrige Dichromatlösungen über 86 ° C kristallisiert oder Natriumdichromatlösungen in Sprühtrocknern getrocknet werden..
Natriumdichromatlösungen mit 69 und 70% w / v werden als bequeme und kostengünstige Methode zum Versenden von Mengen verwendet, ohne dass eine manuelle Handhabung oder Kristallauflösung erforderlich ist..
Reaktivität und Gefahren
Es ist ein starkes Oxidationsmittel. Unverträglich mit starken Säuren. Kontakt mit brennbaren Materialien kann Brände verursachen. Bei Hitze oder Feuer können sich giftige Chromoxiddämpfe bilden.
Das bekannte "Chromsäuregemisch" aus Dichromat und Schwefelsäure mit organischen Rückständen führt zu einer heftigen exothermen Reaktion. Diese Mischung in Kombination mit Acetonresten führt ebenfalls zu einer heftigen Reaktion..
Die Kombination von Dichromat und Schwefelsäure mit Alkoholen, Ethanol und 2-Propanol führt zu einer heftigen exothermen Reaktion. Aufgrund des Auftretens vieler Vorfälle, bei denen Dichromat-Schwefelsäure mit oxidierbaren organischen Materialien gemischt wird, ist es wahrscheinlich am besten, solche Wechselwirkungen zu vermeiden..
Die Kombination von Dichromat mit Hydrazin ist explosiv, es ist zu erwarten, dass die Reaktion von Dichromat mit Aminen im Allgemeinen heftig ist. Die Zugabe des dehydratisierten Dichromat-Salzes zu Essigsäureanhydrid führt zu einer schließlich explosiven exothermen Reaktion..
Bor, Silizium und Dichromat bilden pyrotechnische Gemische. Eine Mischung aus Essigsäure, 2-Methyl-2-pentenal und Dichromat führt zu einer grassierenden Reaktion (Chemical Datasheet Sodium Dichromate., 2016)..
Das Einatmen von Staub oder Nebel führt zu Reizungen der Atemwege, die manchmal Asthma ähneln. Septumperforation kann auftreten. Es gilt als Gift.
Verschlucken verursacht Erbrechen, Durchfall und sehr ungewöhnlich Magen- und Nierenkomplikationen. Kontakt mit Augen oder Haut verursacht lokale Reizungen. Wiederholte Hautexposition verursacht Dermatitis.
Natriumdichromat ist für den Menschen krebserregend. Es gibt Hinweise darauf, dass sechswertige Chrom- oder Cr (VI) -Verbindungen beim Menschen Lungenkrebs verursachen können. Es wurde gezeigt, dass Natriumdichromat bei Tieren Lungenkrebs verursacht.
Obwohl Natriumdichromat nicht als teratogene oder reproduktionsgefährdende Verbindung identifiziert wurde, ist bekannt, dass sechswertige Chrom- oder Cr (VI) -Verbindungen Teratogene sind und reproduktive Schäden verursachen, wie z. B. eine Verringerung der Fruchtbarkeit und eine Störung der Menstruationszyklen..
Natriumdichromat kann Leber- und Nierenschäden verursachen, daher muss es mit äußerster Vorsicht behandelt werden (New Jersey Department of Health, 2009)..
Bei Verschlucken sollte das Opfer Wasser oder Milch trinken. niemals Erbrechen herbeiführen. Bei Kontakt mit der Haut oder den Augen sollte es als Säureverbrennung behandelt werden; Spülen Sie ihre Augen mindestens 15 Minuten lang mit Wasser aus.
Externe Läsionen können mit einer 2% igen Natriumthiosulfatlösung eingerieben werden. In jedem Fall sollte ein Arzt konsultiert werden.
Verwendungen und Anwendungen
Abgesehen von seiner Bedeutung bei der Herstellung anderer Chromchemikalien hat Natriumdichromat auch viele direkte Verwendungen als Bestandteil bei der Herstellung von:
- Metallic-Finish: Verbessert die Korrosionsbeständigkeit und reinigt Metalloberflächen und begünstigt auch die Lackhaftung.
- Bio-Produkte: werden als Oxidationsmittel bei der Herstellung von Produkten wie Vitamin K und Wachs verwendet.
- Pigmente: werden bei der Herstellung von anorganischen Chromatpigmenten verwendet, bei denen eine Reihe von lichtstabilen Farben erzeugt werden. Einige Chromatqualitäten werden auch als Korrosionsinhibitoren in Grundierungen und Grundierungen verwendet..
- Keramik: Zur Herstellung von farbigem Glas und Keramikglasuren.
- Textil: Wird als Beizmittel für Säurefarbstoffe verwendet, um deren schnelle Färbungseigenschaften zu verbessern.
- Chromsulfatproduktion.
(Natriumdichromat. Der Baustein für praktisch alle anderen Chromverbindungen., 2010-2012)
Natriumdichromat-Dihydrat, ideal für den Einsatz unter verschiedenen Bedingungen, einschließlich Hochtemperaturanwendungen wie Keramikglasuren und farbigem Glas.
Chromoxid ist härter als andere Metalloxide wie Titan oder Eisen und eignet sich ideal für Umgebungen, in denen die Temperatur und die Prozessbedingungen aggressiv sind.
Diese Substanz wird hauptsächlich zur Herstellung anderer Chromverbindungen verwendet, aber sie wird auch in Bentonitschlamm verwendet, der bei der Ölherstellung, in Holzschutzmitteln, bei der Herstellung organischer Chemikalien und als Korrosionsinhibitor verwendet wird..
Beim Mischen mit Kaliumaluminiumdichromat unter Verwendung des aluminiumthermischen Verfahrens erzeugt Chromoxid hochreines metallisches Chrom. Dies ist ein wesentlicher Bestandteil bei der Herstellung der in der Luft- und Raumfahrtindustrie verwendeten Hochleistungs-Superlegierungen..
Bei der organischen Synthese wird Natriumdichromat als Oxidationsmittel bei Oxidreduktionsreaktionen in Gegenwart von Schwefelsäure verwendet..
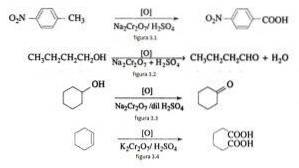
Zum Beispiel die Oxidation von p-Nitrotoluol zu p-Nitrobenzoesäure, die Oxidation von n-Butanol zu n-Butaldehyd, die Bildung von Cyclohexanon aus Cyclohexanol und die Bildung von Adipinsäure, wie in den Abbildungen 3.1, 3.2, 3.3 und 3.4 dargestellt jeweils (VK Ahluwalia, 2004).
Biochemie
Die intratracheale Instillation von Natriumdichromat (CrVI) und Chromacetathydroxid (CrIII) bei männlichen Ratten führte bis zu 72 Stunden nach der Exposition zu erhöhten Chromkonzentrationen in Vollblut, Plasma und Urin. Die Spitzenkonzentrationen wurden 6 Stunden nach der Exposition erreicht..
Das Verhältnis von Vollblutchrom zu Plasma-Chromkonzentrationen war für die Cr (VI) - und Cr (III) -Behandlungen signifikant unterschiedlich. Daher sollten zur Beurteilung der Chromexposition Blutchrom- und Plasma-Chromtests verwendet werden..
Chrom wurde auch in peripheren Lymphozyten nachgewiesen. Cr (VI), aber nicht Cr (III) akkumulierte nach der Behandlung signifikant in Lymphozyten. Diese Zellen können möglicherweise als Biomarker für die Bewertung der Exposition gegenüber Chromverbindungen verwendet werden (Hooth, 2008)..
Verweise
- Chemisches Datenblatt Natriumdichromat. (2016). Aus Cameo-Chemikalien entnommen: Cameochemicals.noaa.
- Hooth, M. J. (2008). Technischer Bericht über Toxikologie- und Karzinogenese-Studien mit dihydratisiertem Natriumdichromat. Nationales Institut für Gesundheit USA.
- Kogel, J. E. (2006). Industrial Minerals & Rocks: Rohstoffe, Märkte und Verwendungszwecke Siebte Ausgabe. Littleton Colorado: Gesellschaft für Bergbau, Metallurgie und Exploration inc.
- Nationales Zentrum für Informationen zur Biotechnologie. (s.f.). PubChem Compound Database; CID = 25408. Von pubchem.com abgerufen: pubchem.ncbi.nlm.nih.gov.
- Gesundheitsministerium von New Jersey. (2009, November). Hazartdous Substanz Fact Sheet Natriumdichromat. Abgerufen von nj.gov: nj.gov.
- Natriumdichromat. Der Baustein für praktisch alle anderen Chromverbindungen. (2010-2012). Von elementis chromium abgerufen: elementischromium.com
- K. Ahluwalia, R. A. (2004). Umfassende praktische organische Chemie: Präparationen und quantitative Analysen. Delhi: Universitätspresse (Indien).

Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.