
Faust Technik Fundament und Materialien, Schritte, Vor- und Nachteile
Das Faust-Technik Es ist eine Methode, die die Konzentration einiger Parasiteneier und / oder Larven, die im Kot enthalten sind, durch Flotation ermöglicht. Es wird verwendet, wenn direkte Stuhltests negativ sind oder wenn Sie saubere Proben ohne Ablagerungen erhalten möchten.
Es gibt drei Arten von Konzentrationsmethoden für koproparasitologische Untersuchungen: durch Flotation, durch Sedimentation oder durch Methoden, die die beiden vorherigen kombinieren. Diese Methoden erhöhen die Chancen auf positive Ergebnisse.

Die Faust-Methode besteht darin, einen Teil der Stuhlprobe mit einer Substanz zu mischen, die dichter ist als die zu konzentrierenden Eier oder Parasiten. Dies führt dazu, dass sie, da sie weniger dicht sind, auf der Oberfläche schweben. Die überstehende Flüssigkeit wird gesammelt und zur Identifizierung und Quantifizierung unter einem Mikroskop betrachtet..
Diese Methode wird verwendet, um Helmintheneier zu visualisieren. Im Gegenzug hat es sich als sehr empfindliche Methode zur Diagnose von erwiesen Giardia Lamblia, ein weltweit verbreitetes Geißelprotozoon. Flotationsmethoden werden für sehr schwere Parasiteneier wie Bandwürmer und Trematoden nicht empfohlen..
Parasiten sind eine der weltweit am weitesten verbreiteten Darminfektionen, insbesondere in armen Ländern mit schlechten Hygienemaßnahmen. Aus diesem Grund sind empfindliche Methoden, mit denen diese Parasiten identifiziert und quantifiziert werden können, für die Diagnose und Behandlung sehr nützlich..
Artikelverzeichnis
- 1 Fundament und Materialien
- 1.1 Materialien
- 2 Schritte
- 2.1 Makroskopische und mikroskopische Untersuchung
- 2.2 Ursprüngliche Faust-Technik
- 2.3 Faust-Technik durch Zentrifugation
- 3 Vorteile
- 4 Nachteile
- 5 Referenzen
Fundament und Materialien
Die Technik basiert auf der Existenz der unterschiedlichen spezifischen Gewichte von Eiern, Parasiten, Zysten, Larven und Detritus unter Verwendung von Zinksulfatlösungen als Flotationsmethode..
Der Grund für die Technik besteht darin, die Probe mit einer Zinksulfatlösung zu mischen, die eine höhere Dichte als leichtere Eier, Larven oder Parasiten aufweist..
Dadurch können die schwersten Elemente ausfallen und die leichteren schwimmen, die nach dem Zentrifugieren der Proben im Überstand erscheinen..
Materialien
- Bereiten Sie eine Zinksulfatlösung mit einer Dichte von 1,18 oder 1,2 g / ml vor, wenn die Probe zuvor behandelt wurde.
- Bereiten Sie ein Gestell mit zuvor beschrifteten Reagenzgläsern vor.
- Haben Sie eine Zentrifugalmaschine.
- Halten Sie Objektträger und Deckgläser bereit. Alle müssen beschriftet sein
- Stellen Sie sicher, dass eine Lugol-Lösung verfügbar ist, um die Blätter zu färben.
- Gaze zum Filtern haben.
- Trichter und destilliertes Wasser haben.
- Suchen Sie beschriftete Kunststoff- oder Kartonbehälter.
- Auch Applikatoren und steriler Griff von 5 mm.
- Ein Feuerzeug zum Sterilisieren des Griffs.
Schritte
Makroskopische und mikroskopische Untersuchung
Bei jeder Stuhluntersuchung beginnt die Untersuchung mit der sogenannten "makroskopischen Untersuchung" der Proben..
Die Konsistenz, Farbe, das Vorhandensein von scheinbar Blut, das Vorhandensein von Schleim und das Vorhandensein von erwachsenen Parasiten werden beschrieben..
Dann fahren wir mit der "mikroskopischen Untersuchung" des Stuhls fort, dies hängt von der Methode ab. Die einfachste ist die direkte Abstrichmethode, die einfachste mikroskopische Beobachtungsmethode für Parasiten..
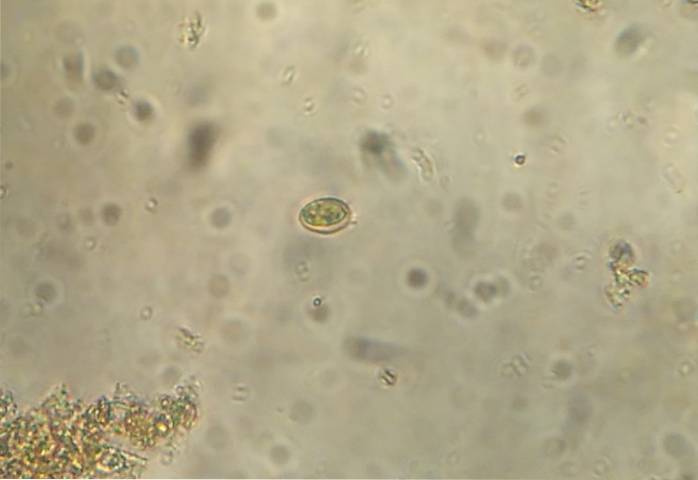
Bei diesem Verfahren wird eine kleine Menge der Probe direkt auf einen Objektträger gelegt. Geben Sie mehrere Tropfen Kochsalzlösung, die der Probe ähnlich groß sein sollten. Mischen Sie die Salzlösung mit dem Stuhl, bis eine homogene Mischung entsteht. Legen Sie ein Deckglas und untersuchen Sie es unter dem Mikroskop.
Ursprüngliche Faust-Technik
Das zweite Verfahren besteht aus der Faust-Flotationsmethode, deren ursprüngliche Version besteht aus:
1- Legen Sie etwa zwei Gramm Kot in einen geeigneten Behälter für diesen Zweck.
2- 30 ml Zinksulfat-Flotationslösung zugeben, mit der eine Emulsion hergestellt wird, indem die Lösung mit dem Kot gemischt wird.
3- Mit einem Metallsieb in einen zweiten Behälter abseihen und in ein Reagenzglas überführen.
4- Fügen Sie mehr Flotationslösung hinzu, bis sich ein Meniskus im Röhrchen bildet.
5- Legen Sie ein Glasdeckglas auf den Meniskus. 10 bis 15 Minuten ruhen lassen.
6- Entfernen Sie das Deckglas und legen Sie es auf einen Objektträger, der unter dem Mikroskop untersucht wird.
Faust-Technik durch Zentrifugation
Ursprünglich wurde bei der Methode keine Zentrifugation verwendet, jetzt ist sie jedoch enthalten, da bessere Ergebnisse erzielt werden. Die Technik umfasst eine Reihe von Schritten, um ein korrektes Verfahren zu erreichen. Diese sind wie folgt:
1- Der Kot wird mit Wasser gewaschen, gut gemischt und dann mit in vier Teile gefalteter Gaze filtriert. Die Probe wird in ein Reagenzglas gegeben.
2- Zentrifugieren und entfernen Sie den Überstand (Proben, die über Wasser aufbewahrt werden). Die Schritte 1 und 2 werden wiederholt, bis der Überstand "klar" ist..
3- Der filtrierten und zentrifugierten Probe wird Zinksulfat zugesetzt.
4- Gut mischen.
5- Nochmals 1 Minute bei 2500 U / min (Umdrehungen pro Minute) zentrifugieren.
6- Der Überstand wird mit einer sterilen Schleife von etwa 5 mm gewonnen; Röhrchen sollten nicht geschüttelt werden.
7- Die aus dem Überstand gewonnene Probe wird auf einen Objektträger gegeben und ein Tropfen Lugol kann zum Färben gegeben werden, das Deckglas wird platziert und unter dem Mikroskop beobachtet.
8- Die Behälter und Reagenzgläser sind gekennzeichnet.
Vorteil
- Die für die Diagnose verwendeten Elemente können sauber und ohne „Detritus“ beobachtet werden. Dies erleichtert die Beobachtung des Blattes und reduziert die für die Diagnose verwendete Zeit..
- Im Überstand werden sowohl Larven als auch Eier und / oder Zysten gewonnen.
- Es ist eine sehr kostengünstige Methode.
- Das Verfahren ist sehr einfach und leicht zu implementieren.
- Die Diagnose ist schnell und genau.
- Aufgrund der Bedeutung und der hohen Inzidenz von Parasitose in armen Ländern sind diese kostengünstigen und benutzerfreundlichen Methoden ideal für die Diagnose und Überwachung dieser Pathologien..
Nachteile
Die Dichte der Flotationslösung führt zu einer Kontraktion der Larven, dh sie schrumpfen und können sich in sehr kurzer Zeit verformen. Dies zwingt den Prüfer, die Diagnose sofort zu stellen, und die behandelten Proben können nicht für zukünftige Untersuchungen aufbewahrt werden..
Wie bei allen mikroskopischen Identifikationsmethoden ist ein sehr erfahrenes Untersuchungspersonal erforderlich, um genaue Diagnosen zu stellen..
Die schnelle Verformung der für die Diagnose erforderlichen Elemente ist zwar ein offensichtlicher Nachteil, kann jedoch durch sofortige mikroskopische Beobachtungen korrigiert werden.
Verweise
- Ananias, F. L. (2017). Bewertung der Sensitivität der Faust-Methode und der spontanen Sedimentation zur Diagnose von Giardiasis. Kubanisches Journal für Tropenmedizin, 68(zwei).
- M. S. Bartlett, K. Harper, N. Smith, P. Verbanac & J. W. Smith (1978). Vergleichende Bewertung einer modifizierten Zinksulfat-Flotationstechnik. Zeitschrift für klinische Mikrobiologie, 7(6), 524 & ndash; 528.
- Becker, A. C., Kraemer, A., Epe, C. & Strube, C. (2016). Empfindlichkeit und Effizienz ausgewählter koproskopischer Methoden - Sedimentation, kombinierte Zinksulfat-Sedimentation - Flotation und McMaster-Methode. Parasitologieforschung, 115(7), 2581 & ndash; 2587.
- Garcia, L. S., Arrowood, M., Kokoskin, E., Paltridge, G. P., Pillai, D. R., Procop, G. W., ... & Visvesvara, G. (2018). Labordiagnose von Parasiten aus dem Magen-Darm-Trakt. Klinische Mikrobiologie Bewertungen, 31(1), e00025-17.
- Summers, W. A. (1942). Eine Modifikation des Zentrifugalflotationsverfahrens für Zinksulfat zur Gewinnung von Helminthen-Eizellen in formalisierten Fäkalien. Zeitschrift für Parasitologie, 28(4), 345 & ndash; 346.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.