
Eigenschaften, Struktur und Verwendung von Schwefelsäure (H2SO4)
Das Schwefelsäure (H.zweiSW4) Es ist eine flüssige, ölige und farblose chemische Verbindung, die unter Freisetzung von Wärme in Wasser löslich ist und Metalle und Textilien angreift. Karbonisiert Holz und die meisten organischen Stoffe bei Kontakt damit, verursacht jedoch wahrscheinlich keinen Brand.
Schwefelsäure ist vielleicht die wichtigste aller schweren Industriechemikalien, und ihr Verbrauch wurde mehrfach als Indikator für den allgemeinen Zustand der Wirtschaft eines Landes angeführt..

Eine langfristige Exposition gegenüber niedrigen Konzentrationen oder eine kurzfristige Exposition gegenüber hohen Konzentrationen kann zu nachteiligen Auswirkungen auf die Gesundheit führen. Die mit Abstand wichtigste Verwendung von Schwefelsäure ist in der Phosphatdüngerindustrie.
Weitere wichtige Anwendungen sind die Erdölraffinierung, die Pigmentherstellung, das Beizen von Stahl, die Gewinnung von Nichteisenmetallen sowie die Herstellung von Sprengstoffen, Waschmitteln, Kunststoffen, Chemiefasern und Pharmazeutika..
Artikelverzeichnis
- 1 Vitriol, der Vorläufer der Schwefelsäure
- 2 Formel
- 3 Chemische Struktur
- 3.1 In 2D
- 3.2 In 3D
- 4 Funktionen
- 4.1 Physikalische und chemische Eigenschaften
- 4.2 Reaktionen mit Luft und Wasser
- 4.3 Entflammbarkeit
- 4.4 Reaktivität
- 4.5 Toxizität
- 5 Verwendungen
- 5.1 Indirekt
- 5.2 Direkt
- 6 Die Entwicklung der Schwefelsäureindustrie
- 6.1 Vitriol-Prozess
- 6.2 Bleikammern
- 7 Aktuelle Produktion: Kontaktprozess
- 7.1 Doppelkontaktprozess
- 8 Rohstoffe für die Herstellung von Schwefelsäure
- 8.1 Pyrit
- 8.2 Schwefeldioxid
- 8.3 Recycelt
- 9 Klinische Wirkungen
- 10 Sicherheit und Risiken
- 10.1 GHS-Gefahrenklassen
- 10.2 Codes für Vorsichtsmaßnahmen
- 11 Referenzen
Vitriol, der Vorläufer der Schwefelsäure
Im mittelalterlichen Europa war Schwefelsäure von Alchemisten als Vitriol, Vitriolöl oder Vitriollauge bekannt. Es wurde als die wichtigste chemische Substanz angesehen und als Stein der Weisen verwendet.
Die Sumerer hatten bereits eine Liste verschiedener Arten von Vitriol. Darüber hinaus haben Galen, der griechische Arzt Dioscorides und Plinius der Ältere seine medizinische Verwendung erhöht.

In hellenistischen alchemistischen Arbeiten wurden bereits die metallurgischen Verwendungen von Vitriolsubstanzen erwähnt. Vitriol ist eine Gruppe von Glasmineralien, aus denen Schwefelsäure gewonnen werden kann.
Formel
-Formel: H.zweiSW4
-CAS-Nummer: 7664-93-9
Chemische Struktur
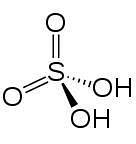
In 2D
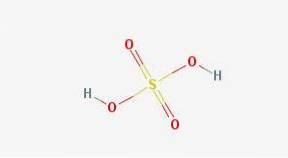
In 3d
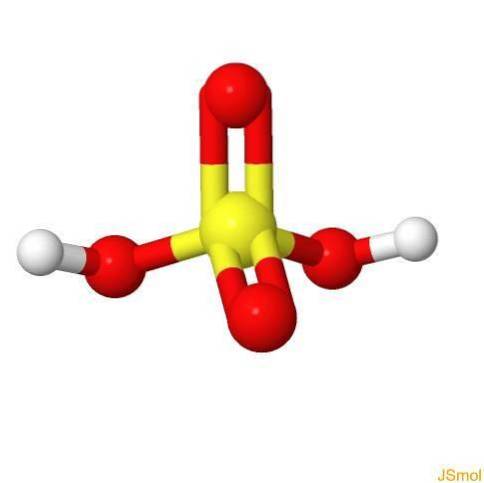
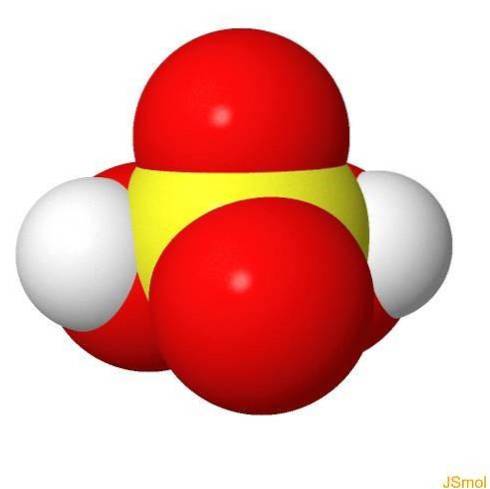
Eigenschaften
Physikalische und chemische Eigenschaften

Schwefelsäure gehört zur reaktiven Gruppe stark oxidierender Säuren.
Reaktionen mit Luft und Wasser
- Die Reaktion mit Wasser ist vernachlässigbar, es sei denn, der Säuregehalt liegt über 80-90%. Dann ist die Hydrolysewärme extrem und es kann zu schweren Verbrennungen kommen.
Entzündbarkeit
- Stark oxidierende Säuren sind im Allgemeinen nicht brennbar. Sie können die Verbrennung anderer Materialien beschleunigen, indem sie der Verbrennungsstelle Sauerstoff zuführen.
- Schwefelsäure ist jedoch hochreaktiv und kann fein verteilte brennbare Materialien entzünden, wenn sie mit ihnen in Kontakt kommt..
- Beim Erhitzen entstehen hochgiftige Dämpfe.
- Es ist explosiv oder mit einer Vielzahl von Substanzen nicht kompatibel.
- Kann bei hohen Temperaturen und hohem Druck heftigen chemischen Veränderungen unterliegen.
- Kann heftig mit Wasser reagieren.
Reaktivität
- Schwefelsäure ist stark sauer.
- Reagiert heftig mit Brompentafluorid.
- Bei 80 ° C mit para-Nitrotoluol explodieren.
- Eine Explosion tritt auf, wenn konzentrierte Schwefelsäure mit kristallinem Kaliumpermanganat in einem Behälter gemischt wird, der Feuchtigkeit enthält. Es entsteht Manganheptoxid, das bei 70 ° C explodiert.
- Das Gemisch von Acrylnitril mit konzentrierter Schwefelsäure muss gut gekühlt aufbewahrt werden, da sonst eine heftige exotherme Reaktion auftritt.
- Die Temperatur und der Druck steigen an, wenn Schwefelsäure (96%) zu gleichen Teilen in einem geschlossenen Behälter mit einer der folgenden Substanzen gemischt wird: Acetonitril, Acrolein, 2-Aminoethanol, Ammoniumhydroxid (28%), Anilin, n-Butyraldehyd, Chlorsulfon Säure, Ethylendiamin, Ethylenimin, Epichlorhydrin, Ethylencyanhydrin, Salzsäure (36%), Flusssäure (48,7%), Propylenoxid, Natriumhydroxid, Styrolmonomer.
- Schwefelsäure (konzentriert) ist im Kontakt mit Carbiden, Bromaten, Chloraten, Primern, Pikraten und Metallpulvern äußerst gefährlich..
- Kann eine heftige Polymerisation von Allylchlorid induzieren und reagiert exotherm mit Natriumhypochlorit unter Bildung von Chlorgas.
- Das Mischen von Chlorschwefelsäure und 98% iger Schwefelsäure ergibt HCl.
Toxizität
- Schwefelsäure wirkt ätzend auf alle Gewebe im Körper. Das Einatmen von Dampf kann schwere Lungenschäden verursachen. Kontakt mit den Augen kann zu einem völligen Verlust des Sehvermögens führen. Hautkontakt kann zu schwerer Nekrose führen.
- Das Verschlucken von Schwefelsäure in einer Menge zwischen 1 Teelöffel und einer halben Unze der konzentrierten Chemikalie kann für einen Erwachsenen tödlich sein. Schon ein paar Tropfen können tödlich sein, wenn die Säure in die Luftröhre gelangt.
- Chronische Exposition kann Tracheobronchitis, Stomatitis, Konjunktivitis und Gastritis verursachen. Magenperforation und Peritonitis können auftreten und von einem Kreislaufkollaps gefolgt werden. Kreislaufschock ist oft die unmittelbare Todesursache.
- Menschen mit chronischen Erkrankungen der Atemwege, des Magen-Darm-Trakts oder der Nerven sowie Augen- und Hauterkrankungen sind einem erhöhten Risiko ausgesetzt.
Anwendungen
- Schwefelsäure ist eine der weltweit am häufigsten verwendeten Industriechemikalien. Die meisten seiner Verwendungen können jedoch als indirekt angesehen werden und sind eher als Reagenz als als Bestandteil enthalten.
- Der größte Teil der Schwefelsäure endet als die Säure, die bei der Herstellung anderer Verbindungen verbraucht wird, oder als eine Art Sulfatrückstand.
- Eine Reihe von Produkten enthalten Schwefel oder Schwefelsäure, aber fast alle von ihnen sind spezielle Produkte mit geringem Volumen..
- Ungefähr 19% der 2014 produzierten Schwefelsäure wurden in ungefähr zwanzig chemischen Prozessen verbraucht, und der Rest wurde in einer Vielzahl von industriellen und technischen Anwendungen verbraucht.
- Der weltweite Anstieg der Nachfrage nach Schwefelsäure ist in abnehmender Reihenfolge auf die Produktion von Phosphorsäure, Titandioxid, Flusssäure, Ammoniumsulfat sowie bei der Uranverarbeitung und metallurgischen Anwendungen zurückzuführen.
Indirekt
- Der mit Abstand größte Verbraucher von Schwefelsäure ist die Düngemittelindustrie. Sie machte 2014 etwas mehr als 58% des weltweiten Gesamtverbrauchs aus. Es wird jedoch erwartet, dass dieser Anteil bis 2019 auf etwa 56% sinken wird, was hauptsächlich auf das höhere Wachstum bei anderen chemischen und industriellen Anwendungen zurückzuführen ist..
- Die Herstellung von Phosphatdüngermaterialien, insbesondere Phosphorsäure, ist der Hauptmarkt für Schwefelsäure. Es wird auch zur Herstellung von Düngemitteln wie dreifachem Superphosphat sowie Mono- und Diammoniumphosphaten verwendet. Kleinere Mengen werden zur Herstellung von Superphosphat und Ammoniumsulfat verwendet.
- In anderen industriellen Anwendungen werden erhebliche Mengen an Schwefelsäure als Säuredehydratisierungsreaktionsmedium verwendet, in der organischen Chemie und in petrochemischen Prozessen, die Reaktionen wie Nitrierung, Kondensation und Dehydratisierung beinhalten, sowie in der Erdölraffination, wo sie in der Raffinieren, Alkylieren und Reinigen von Rohdestillaten.
- In der anorganischen chemischen Industrie ist seine Verwendung bei der Herstellung von TiO 2 -Pigmenten, Salzsäure und Flusssäure bemerkenswert..
- In der metallverarbeitenden Industrie wird Schwefelsäure zum Beizen von Stahl, zum Auswaschen von Kupfer-, Uran- und Vanadiumerzen bei der hydrometallurgischen Verarbeitung von Mineralien und zur Herstellung von Elektrolytbädern zur Reinigung und Plattierung von Metallen verwendet. Eisen.
- Bestimmte Verfahren zur Herstellung von Zellstoff in der Papierindustrie, zur Herstellung einiger Textilien, zur Herstellung chemischer Fasern und zum Gerben von Häuten erfordern ebenfalls Schwefelsäure.
Direkte
- Die wahrscheinlich größte Verwendung von Schwefelsäure, bei der Schwefel in das Endprodukt eingearbeitet wird, ist der organische Sulfonierungsprozess, insbesondere zur Herstellung von Waschmitteln..
- Die Sulfonierung spielt auch eine wichtige Rolle bei der Gewinnung anderer organischer Chemikalien und kleinerer Pharmazeutika..
- Blei-Säure-Batterien sind eines der bekanntesten schwefelsäurehaltigen Verbraucherprodukte und machen nur einen kleinen Teil des gesamten Schwefelsäureverbrauchs aus..
- Unter bestimmten Bedingungen wird Schwefelsäure direkt in der Landwirtschaft zur Sanierung stark alkalischer Böden verwendet, wie sie beispielsweise in den Wüstenregionen im Westen der USA vorkommen. Diese Verwendung ist jedoch im Hinblick auf das Gesamtvolumen der verwendeten Schwefelsäure nicht sehr wichtig..
Die Entwicklung der Schwefelsäureindustrie
Vitriol-Prozess

Die älteste Methode zur Gewinnung von Schwefelsäure ist das sogenannte „Vitriol-Verfahren“, das auf der thermischen Zersetzung von Vitriolen basiert, bei denen es sich um Sulfate verschiedener Arten natürlichen Ursprungs handelt..
Die persischen Alchemisten Jābir ibn Hayyān (auch bekannt als Geber, 721 - 815 n. Chr.), Razi (865 - 925 n. Chr.) Und Jamal Din al-Watwat (1318 n. Chr.) Haben Vitriol in ihre Mineralklassifizierungslisten aufgenommen.
Die erste Erwähnung des "Vitriol-Prozesses" erscheint in den Schriften von Jabir ibn Hayyan. Dann haben die Alchemisten St. Albert der Große und Basilius Valentinus den Prozess genauer beschrieben. Als Rohstoffe wurden Alaun und Chalkanthit (blaues Vitriol) verwendet.
Am Ende des Mittelalters wurde Schwefelsäure in geringen Mengen in Glasbehältern gewonnen, in denen Schwefel mit Salpeter in feuchter Umgebung verbrannt wurde..
Das Vitriol-Verfahren wurde ab dem 16. Jahrhundert aufgrund der höheren Nachfrage nach Schwefelsäure im industriellen Maßstab eingesetzt.
Vitriol von Nordhausen
Der Schwerpunkt der Produktion lag in der deutschen Stadt Nordhausen (weshalb das Vitriol als „Nordhausen-Vitriol“ bezeichnet wurde), wo Eisen (II) -sulfat (grünes Vitriol, FeSO)4 - 7HzweiO) als Rohmaterial, das erhitzt wurde, und das resultierende Schwefeltrioxid wurde mit Wasser gemischt, um Schwefelsäure (Öl von Vitriol) zu erhalten..
Der Prozess wurde in Galeeren durchgeführt, von denen einige mehrere Ebenen parallel hatten, um größere Mengen an Vitriolöl zu erhalten..
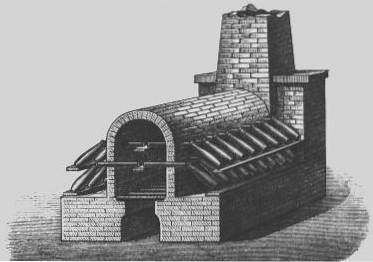
Bleikammern
Im 18. Jahrhundert wurde ein wirtschaftlicheres Verfahren zur Herstellung von Schwefelsäure entwickelt, das als "Bleikammerverfahren" bekannt ist..
Bis dahin betrug die maximale erhaltene Säurekonzentration 78%, während mit dem "Vitriol-Verfahren" konzentrierte Säure und Oleum erhalten wurden, so dass dieses Verfahren in bestimmten Sektoren der Industrie bis zum Auftreten des "Kontaktprozesses" weiter angewendet wurde. im Jahr 1870, mit dem konzentrierte Säure billiger erhalten werden konnte.
Oleum oder rauchende Schwefelsäure (CAS: 8014-95-7) ist eine Lösung von öliger Konsistenz und dunkelbrauner Farbe mit einer variablen Zusammensetzung von Schwefeltrioxid und Schwefelsäure, die durch die Formel H beschrieben werden kannzweiSW4.xSO3 (wobei x den freien Molgehalt von Schwefeloxid (VI) darstellt). Ein Wert für x von 1 ergibt die Summenformel H.zweiS.zweiODER7, entsprechend Schwefelsäure (oder Pyroschwefelsäure).
Prozess
Das Bleikammerverfahren war das industrielle Verfahren zur Herstellung von Schwefelsäure in großen Mengen, bevor es durch das "Kontaktverfahren" ersetzt wurde..
1746 begann John Roebuck in Birmingham, England, mit der Herstellung von Schwefelsäure in mit Blei ausgekleideten Kammern, die stärker und billiger als zuvor verwendete Glasbehälter waren und viel größer gemacht werden konnten.
Schwefeldioxid (aus der Verbrennung von elementarem Schwefel oder schwefelhaltigen metallischen Mineralien wie Pyrit) wurde mit Dampf und Stickoxid in große Kammern eingeleitet, die mit Bleiblättern ausgekleidet waren..
Das Schwefeldioxid und das Stickstoffdioxid lösten sich auf und über einen Zeitraum von ungefähr 30 Minuten wurde das Schwefeldioxid zu Schwefelsäure oxidiert..
Dies ermöglichte die effektive Industrialisierung der Schwefelsäureproduktion und mit verschiedenen Verfeinerungen blieb dieses Verfahren fast zwei Jahrhunderte lang die Standardproduktionsmethode..
1793 erzielten Clemente und Desormes bessere Ergebnisse, indem sie zusätzliche Luft in den Bleikammerprozess einführten..
1827 führte Gay-Lussac eine Methode zur Absorption von Stickoxiden aus den Abgasen der Bleikammer ein..
1859 entwickelte Glover eine Methode zur Rückgewinnung von Stickoxiden aus neu gebildeter Säure durch Strippen mit heißen Gasen, die es ermöglichte, den Stickoxid-katalysierenden Prozess kontinuierlich durchzuführen..
1923 führte Petersen ein verbessertes Turmverfahren ein, das es ihm ermöglichte, bis in die 1950er Jahre mit dem Kontaktverfahren konkurrenzfähig zu sein..
Das Kammerverfahren wurde so robust, dass es 1946 noch 25% der weltweiten Schwefelsäureproduktion ausmachte..
Aktuelle Produktion: Kontaktprozess
Das Kontaktverfahren ist das derzeitige Verfahren zur Herstellung von Schwefelsäure in hohen Konzentrationen, das in modernen industriellen Verfahren erforderlich ist. Platin war früher der Katalysator für diese Reaktion. Vanadiumpentoxid (V2O5) ist jetzt jedoch bevorzugt.
1831 patentierte Peregrine Phillips in Bristol, England, die Oxidation von Schwefeldioxid zu Schwefeltrioxid unter Verwendung eines Platinkatalysators bei erhöhten Temperaturen..
Die Übernahme seiner Erfindung und die intensive Entwicklung des Kontaktverfahrens begannen jedoch erst, nachdem die Nachfrage nach Oleum zur Herstellung von Farbstoffen ab etwa 1872 zunahm..
Als nächstes wurden bessere feste Katalysatoren gesucht und die Chemie und Thermodynamik des SO2 / SO3-Gleichgewichts untersucht..
Der Kontaktprozess kann in fünf Phasen unterteilt werden:
- Kombination von Schwefel und Disauerstoff (O2) zu Schwefeldioxid.
- Reinigung von Schwefeldioxid in einer Reinigungseinheit.
- Zugabe von überschüssigem Sauerstoff zu Schwefeldioxid in Gegenwart eines Vanadiumpentoxidkatalysators bei Temperaturen von 450ºC und einem Druck von 1 bis 2 atm.
- Das gebildete Schwefeltrioxid wird zu der Schwefelsäure gegeben, wodurch Oleum (Schwefelsäure) entsteht..
- Das Wasser wird dann mit Oleum versetzt, um hochkonzentrierte Schwefelsäure zu bilden..
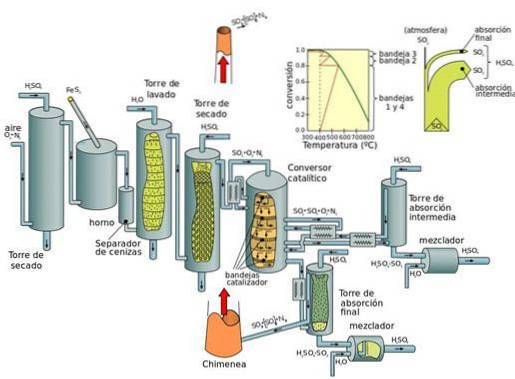
Der grundlegende Nachteil von Stickoxidprozessen (während des Bleikammerprozesses) besteht darin, dass die Konzentration der erhaltenen Schwefelsäure auf maximal 70 bis 75% begrenzt ist, während der Kontaktprozess konzentrierte Säure (98%) erzeugt..
Mit der Entwicklung relativ kostengünstiger Vanadiumkatalysatoren für den Kontaktprozess in Verbindung mit der steigenden Nachfrage nach konzentrierter Schwefelsäure ging die weltweite Produktion von Schwefelsäure in Stickoxidverarbeitungsbetrieben stetig zurück..
Bis 1980 wurde in Stickoxidverarbeitungsbetrieben in Westeuropa und Nordamerika praktisch keine Säure produziert.
Doppelkontaktprozess
Das Doppelkontakt-Doppelabsorptionsverfahren (DCDA oder Doppelkontakt-Doppelabsorption) führte Verbesserungen des Kontaktverfahrens zur Herstellung von Schwefelsäure ein.
1960 meldete Bayer ein Patent für das sogenannte Doppelkatalyseverfahren an. Die erste Anlage, die dieses Verfahren einsetzte, wurde 1964 in Betrieb genommen.
Durch Einbau einer SO-Absorptionsstufe3 Vor den letzten katalytischen Stufen ermöglichte der verbesserte Kontaktprozess eine signifikante Erhöhung der SO-Umwandlung.zwei , wesentliche Reduzierung seiner Emissionen in die Atmosphäre.
Die Gase werden durch die endgültige Absorptionskolonne zurückgeführt, wodurch nicht nur eine hohe SO-Umwandlungsleistung erzielt wirdzwei zu SO3 (von ca. 99,8%), ermöglicht aber auch die Herstellung einer höheren Schwefelsäurekonzentration.
Der wesentliche Unterschied zwischen diesem Prozess und dem normalen Kontaktprozess besteht in der Anzahl der Absorptionsstufen..
Ab den 1970er Jahren führten die wichtigsten Industrieländer strengere Vorschriften zum Schutz der Umwelt ein, und der doppelte Übernahmevorgang verbreitete sich in neuen Anlagen weiter. Das konventionelle Kontaktverfahren wird jedoch in vielen Entwicklungsländern mit weniger strengen Umweltstandards immer noch angewendet..
Der größte Anstoß für die derzeitige Entwicklung des Kontaktprozesses ist die Steigerung der Rückgewinnung und Nutzung der im Prozess erzeugten großen Energiemenge..
Tatsächlich kann eine große moderne Schwefelsäureanlage nicht nur als Chemiefabrik, sondern auch als Wärmekraftwerk angesehen werden..
Rohstoffe für die Herstellung von Schwefelsäure
Pyrit
Pyrit war der dominierende Rohstoff bei der Herstellung von Schwefelsäure bis zur Mitte des 20. Jahrhunderts, als große Mengen an elementarem Schwefel aus dem Ölraffinierungsprozess und der Reinigung von Erdgas gewonnen wurden und zur Hauptprämie der Materialindustrie wurden.
Schwefeldioxid
Derzeit wird Schwefeldioxid nach verschiedenen Methoden aus verschiedenen Rohstoffen gewonnen.
In den Vereinigten Staaten basiert die Industrie seit den frühen Jahren des 20. Jahrhunderts auf der Gewinnung von elementarem Schwefel aus unterirdischen Lagerstätten nach dem "Frasch-Verfahren"..
Mäßig konzentrierte Schwefelsäure wird auch durch Rekonzentration und Reinigung großer Mengen Schwefelsäure hergestellt, die als Nebenprodukt anderer industrieller Verfahren anfallen..
Recycling
Das Recycling dieser Säure wird aus ökologischer Sicht immer wichtiger, insbesondere in den wichtigsten Industrieländern..
Die Herstellung von Schwefelsäure auf der Basis von elementarem Schwefel und Pyrit ist natürlich relativ empfindlich gegenüber Marktbedingungen, da die aus diesen Materialien hergestellte Säure ein Primärprodukt darstellt..
Wenn dagegen Schwefelsäure ein Nebenprodukt ist, das zur Entfernung von Abfällen aus einem anderen Verfahren hergestellt wird, wird das Produktionsniveau nicht von den Bedingungen auf dem Schwefelsäuremarkt bestimmt, sondern von den Marktbedingungen für das Primärprodukt.
Klinische Wirkungen
-Schwefelsäure wird in der Industrie und in einigen Haushaltsreinigungsmitteln wie Badreinigern verwendet. Wird auch in Batterien verwendet.
-Vorsätzliche Einnahme, insbesondere von hochkonzentrierten Produkten, kann zu schweren Verletzungen und zum Tod führen. Diese Verschlucken-Expositionen sind in den USA selten, in anderen Teilen der Welt jedoch weit verbreitet..
-Es ist eine starke Säure, die Gewebeschäden und Proteingerinnung verursacht. Es ist ätzend für Haut, Augen, Nase, Schleimhäute, Atemwege und Magen-Darm-Trakt oder jedes Gewebe, mit dem es in Kontakt kommt..
-Die Schwere der Verletzung wird durch die Konzentration und Dauer des Kontakts bestimmt.
-Mildere Expositionen (Konzentrationen unter 10%) verursachen nur Reizungen der Haut, der oberen Atemwege und der Magen-Darm-Schleimhaut.
-Die Auswirkungen einer akuten Inhalationsexposition auf die Atemwege umfassen: Reizung der Nase und des Rachens, Husten, Niesen, Reflexbronchospasmus, Atemnot und Lungenödem. Der Tod kann durch plötzlichen Kreislaufkollaps, Glottisödem und Atemwegsbeteiligung oder akute Lungenverletzung verursacht werden.
-Die Einnahme von Schwefelsäure kann zu sofortigen Magenschmerzen, Übelkeit, Speichelfluss und Erbrechen von Schleimhaut oder hämorrhagischem Material führen, das wie „Kaffeesatz“ aussieht. Gelegentlich wird Erbrechen von frischem Blut beobachtet.
-Die Einnahme von konzentrierter Schwefelsäure kann zu Korrosion der Speiseröhre, Nekrose und Perforation der Speiseröhre oder des Magens führen, insbesondere im Pylorus. Gelegentlich tritt eine Verletzung des Dünndarms auf. Spätere Komplikationen können Stenose und Fistelbildung sein. Nach der Einnahme kann sich eine metabolische Azidose entwickeln.
-Bei Nekrose und Narbenbildung können schwere Hautverbrennungen auftreten. Diese können tödlich sein, wenn ein ausreichend großer Bereich der Körperoberfläche betroffen ist..
-Das Auge ist besonders empfindlich gegen Korrosionsverletzungen. Reizungen, Risse und Bindehautentzündungen können sich bereits bei geringen Schwefelsäurekonzentrationen entwickeln. Spritzer mit Schwefelsäure in hohen Konzentrationen verursachen: Hornhautverbrennungen, Sehverlust und gelegentlich Perforation des Globus.
-Chronische Exposition kann mit Veränderungen der Lungenfunktion, chronischer Bronchitis, Bindehautentzündung, Emphysem, häufigen Infektionen der Atemwege, Gastritis, Erosion des Zahnschmelzes und möglicherweise Krebs der Atemwege verbunden sein..
Sicherheit und Risiken
Gefahrenhinweise des global harmonisierten Systems zur Einstufung und Kennzeichnung von Chemikalien (GHS)
Das global harmonisierte System zur Einstufung und Kennzeichnung von Chemikalien (GHS) ist ein international vereinbartes System, das von den Vereinten Nationen geschaffen wurde, um die verschiedenen in verschiedenen Ländern verwendeten Klassifizierungs- und Kennzeichnungsstandards durch einheitliche Kriterien auf globaler Ebene zu ersetzen (Nations United, 2015) ).
Die Gefahrenklassen (und das entsprechende GHS-Kapitel), die Klassifizierungs- und Kennzeichnungsstandards sowie die Empfehlungen für Schwefelsäure lauten wie folgt (Europäische Chemikalienagentur, 2017; Vereinte Nationen, 2015; PubChem, 2017):
GHS-Gefahrenklassen
H303: Kann beim Verschlucken schädlich sein [Warnung Akute Toxizität, oral - Kategorie 5] (PubChem, 2017).
H314: Verursacht schwere Hautverbrennungen und Augenschäden [Gefahr Hautkorrosion / -reizung - Kategorie 1A, B, C] (PubChem, 2017).
H318: Verursacht schwere Augenschäden [Gefahr Schwerer Augenschaden / Augenreizung - Kategorie 1] (PubChem, 2017).
H330: Durch Einatmen tödlich [Gefahr Akute Toxizität, Einatmen - Kategorie 1, 2] (PubChem, 2017).
H370: Verursacht Organschäden [Gefährdungsspezifische Zielorgan-Toxizität, einmalige Exposition - Kategorie 1] (PubChem, 2017).
H372: Verursacht Organschäden durch längere oder wiederholte Exposition [Gefahr Spezifische Zielorgan-Toxizität, wiederholte Exposition - Kategorie 1] (PubChem, 2017).
H402: Schädlich für Wasserlebewesen [Gefährlich für die aquatische Umwelt, akute Gefahr - Kategorie 3] (PubChem, 2017).
Codes für Vorsichtsmaßnahmen
P260, P264, P270, P271, P273, P280, P284, P301 + P330 + P331, P303 + P361 + P353, P304 + P340, P305 + P351 + P338, P307 + P311, P310, P312, P314, P320, P321 P363, P403 + P233, P405 und P501 (PubChem, 2017).
Verweise
- Arribas, H. (2012) Diagramm der Herstellung von Schwefelsäure nach der Kontaktmethode unter Verwendung von Pyrit als Rohmaterial [Bild] Aus wikipedia.org gewonnen.
- Chemical Economics Handbook, (2017). Schwefelsäure. Von ihs.com wiederhergestellt.
- Chemical Economics Handbook, (2017.) Weltweiter Verbrauch von Schwefelsäure - 2013 [Bild]. Von ihs.com wiederhergestellt.
- ChemIDplus, (2017). 3D-Struktur von 7664-93-9 - Schwefelsäure [Bild] Wiedergewonnen aus: chem.nlm.nih.gov.
- Codici Ashburnhamiani (1166). Porträt von "Geber" aus dem 15. Jahrhundert. Laurenziana Medicea Bibliothek [Bild]. Von wikipedia.org wiederhergestellt.
- Europäische Chemikalienagentur (ECHA), (2017). Zusammenfassung der Klassifizierung und Kennzeichnung. Harmonisierte Einstufung - Anhang VI der Verordnung (EG) Nr. 1272/2008 (CLP-Verordnung).
- Gefahrstoffdatenbank (HSDB). TOXNET. (2017). Schwefelsäure. Bethesda, MD, EU: Nationalbibliothek für Medizin. Wiederhergestellt von: toxnet.nlm.nih.gov.
- Leyo (2007) Skelettformel der Schwefelsäure [Bild]. Wiederhergestellt von: commons.wikimedia.org.
- Liebigs Fleischauszug (1929) Albertus Magnus, Chimistes feiert [Bild]. Wiederhergestellt von: wikipedia.org.
- Müller, H. (2000). Schwefelsäure und Schwefeltrioxid. In Ullmanns Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA. Verfügbar unter: doi.org.
- Vereinte Nationen (2015). Global harmonisiertes System zur Klassifizierung und Kennzeichnung von Chemikalien (GHS) Sechste überarbeitete Ausgabe. New York, EU: Veröffentlichung der Vereinten Nationen. Wiederhergestellt von: unece.org.
- Nationales Zentrum für Informationen zur Biotechnologie. PubChem Compound Database, (2017). Schwefelsäure - PubChem-Struktur. [Bild] Bethesda, MD, EU: National Library of Medicine. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.
- Nationales Zentrum für Informationen zur Biotechnologie. PubChem Compound Database, (2017). Schwefelsäure. Bethesda, MD, EU: Nationalbibliothek für Medizin. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Chemisches Datenblatt. Schwefelsäure, verbraucht. Silver Spring, MD. EU; Wiederhergestellt von: comeochemicals.noaa.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Chemisches Datenblatt. Schwefelsäure. Silver Spring, MD. EU; Wiederhergestellt von: comeochemicals.noaa.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Datenblatt für reaktive Gruppen. Säuren, stark oxidierend. Silver Spring, MD. EU; Wiederhergestellt von: comeochemicals.noaa.gov.
- Oelen, W. (2011) Schwefelsäure 96 Prozent extra rein [Bild]. Wiederhergestellt von: wikipedia.org.
- Oppenheim, R. (1890). Schwefelsäurefabrik nach dem Bleikammerverfahren in der zweiten Hälfte des 19. Lehrbuchs der Technischen Chemie [Bild]. Wiederhergestellt von: wikipedia.org.
- Priesner, C. (1982) Johann Christian Bernhardt und die Vitriolsäure, in: Chemie in unserer Zeit. [Bild]. Wiederhergestellt von: wikipedia.org.
- Stephanb (2006) Kupfersulfat [Bild]. Wiederhergestellt von: wikipedia.org.
- Stolz, D. (1614) Alchemistisches Diagramm. Theatrum Chymicum [Bild] Wiederhergestellt von: wikipedia.org.
- Wikipedia, (2017). Schwefelsäure. Wiederhergestellt von: wikipedia.org.
- Wikipedia, (2017). Schwefelsäure. Wiederhergestellt von: wikipedia.org.
- Wikipedia, (2017). Bleikammerverfahren. Wiederhergestellt von: wikipedia.org.
- Wikipedia, (2017). Kontaktprozess. Wiederhergestellt von: wikipedia.org.
- Wikipedia, (2017). Bleikammerprozess. Wiederhergestellt von: wikipedia.org.
- Wikipedia, (2017). Oleum. Wiederhergestellt von: https://en.wikipedia.org/wiki/Oleum
- Wikipedia, (2017). Oleum. Wiederhergestellt von: https://es.wikipedia.org/wiki/%C3%93leum
- Wikipedia, (2017). Schwefeloxid Wiederhergestellt von: wikipedia.org.
- Wikipedia, (2017). Vitriol-Prozess. Wiederhergestellt von: wikipedia.org.
- Wikipedia, (2017). Schwefeldioxid. Wiederhergestellt von: wikipedia.org.
- Wikipedia, (2017). Schwefeltrioxid. Wiederhergestellt von: wikipedia.org.
- Wikipedia, (2017). Schwefelsäure. Wiederhergestellt von: wikipedia.org.
- Wikipedia, (2017). Vitriolverfahren. Wiederhergestellt von: wikipedia.org.
- Wright, J. (1770) Der Alchymist entdeckt auf der Suche nach dem Stein der Weisen Phosphor und betet für den erfolgreichen Abschluss seiner Operation, wie es der Brauch der antiken chymischen Astrologen war. [Bild] Wiederhergestellt von: wikipedia.org.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.