
Eigenschaften, Risiken und Verwendungen von Kaliumferrocyanid
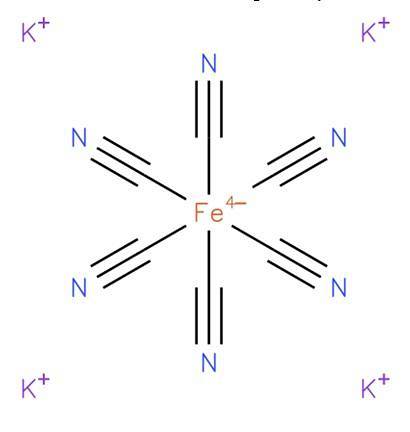
Das Kaliumferrocyanid, auch bekannt als Kaliumhexacyanoferrat (II) oder preußisches Gelb, ist es eine anorganische Verbindung der Formel K.4[Glaube (CN)6]. Es ist ein Kaliumsalz des Ferrocyanid-Koordinationskomplexes (Fe (CN)).64-) und liegt in der Regel in der Trihydratform K vor4[Glaube (CN)6] · H.zweiO. Seine Struktur ist in Abbildung 1 dargestellt (EMBL-EBI, 2008)..
In der Vergangenheit wurde es aus Kohlendioxidquellen aus biologischem Anbau, Eisenspänen und Kaliumcarbonat hergestellt. Übliche Quellen für Stickstoff und Kohlenstoff waren Altleder, Innereien oder getrocknetes Blut.
Derzeit wird Kaliumferrocyanid industriell aus Cyanwasserstoff, Eisenchlorid und Calciumhydroxid hergestellt, dessen Kombination Ca ergibtzwei [Glaube (CN) 6] · 11HzweiODER.
Diese Lösung wird dann mit Kaliumsalzen behandelt, um das gemischte Calcium-Kalium-CaK-Salz auszufällen.zwei [Glaube (CN) 6], das wiederum mit Kaliumcarbonat behandelt wird, um das Tetrapotiumsalz zu ergeben.
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften
- 2 Reaktivität und Gefahren
- 2.1 Augenkontakt
- 2.2 Hautkontakt
- 2.3 Einatmen
- 2.4 Verschlucken
- 3 Verwendungen
- 3.1 1- Lebensmittelindustrie
- 3.2 2- Bergbau- und Metallurgieindustrie
- 3.3 3- Laborreagenz
- 4 Referenzen
Physikalische und chemische Eigenschaften
Kaliumferrocyanid ist ein monokliner Kristall von gelber oder hellgelber Farbe, je nach Hydratationsgrad, ohne charakteristisches Aroma (National Center for Biotechnology Information., 2017). Sein Aussehen ist in Abbildung 2 dargestellt (Kaliumferrocyanid, 2017)..

Die Verbindung hat ein Molekulargewicht von 368,35 g / mol für die wasserfreie Form und 422,388 g / mol für die Trihydratform. Es hat eine Dichte von 1,85 g / ml und einen Schmelzpunkt von 70 ° C, wo es sich zu zersetzen beginnt (Royal Society of Chemistry, 2015)..
Die Verbindung ist wasserlöslich und kann 28,9 g der Verbindung in 100 ml dieses Lösungsmittels lösen. Es ist unlöslich in Diethylether, Ethanol und Toluol. Die Verbindung reagiert auf Hitze unter Bildung von Kaliumcyanid gemäß der Reaktion:
K.4[Glaube (CN)6] → 4 KCN + FeCzwei + N.zwei
In Kombination mit konzentrierten Säuren bildet es Cyanwasserstoff (HCN), ein hochgiftiges, brennbares Gas, das in der Luft explosive Gemische bilden kann (Laffort, 2001)..
Reaktivität und Gefahren
Kaliumferrocyanid ist eine stabile Verbindung, die mit starken Säuren und Oxidationsmitteln nicht kompatibel ist. Kaliumferrocyanid ist ungiftig und zerfällt im Körper nicht in Cyanid. Die Toxizität bei Ratten ist mit einer tödlichen Dosis (LD50) von 6400 mg / kg gering.
Die Substanz ist giftig für Lunge und Schleimhaut. Die Verbindung kann bei Kontakt mit Haut und Augen zu Reizungen führen..
Bei Verschlucken kann es zu einer Reizung des Magen-Darm-Trakts und bei Inhalation zu einer Reizung der Nasenschleimhaut und der Atemwege kommen..
Kontakt mit den Augen kann zu Hornhautschäden oder Blindheit führen. Hautkontakt kann Entzündungen und Blasen verursachen.
Das Einatmen von Staub führt zu Reizungen des Magen-Darm-Trakts oder der Atemwege, die durch Brennen, Niesen und Husten gekennzeichnet sind. Schwere Überbelichtung kann zu Lungenschäden, Erstickung, Bewusstlosigkeit oder zum Tod führen..
Blickkontakt
Bei Kontakt mit den Augen sollten die Kontaktlinsen überprüft und entfernt werden. Die Augen sollten sofort mindestens 15 Minuten lang mit viel kaltem Wasser gespült werden.
Hautkontakt
Der betroffene Bereich sollte sofort mindestens 15 Minuten lang mit viel Wasser gespült werden, während kontaminierte Kleidung und Schuhe entfernt werden. Bedecken Sie gereizte Haut mit einem Weichmacher.
Waschen Sie Kleidung und Schuhe vor der Wiederverwendung. Bei starkem Kontakt mit einer Desinfektionsseife waschen und die kontaminierte Haut mit einer antibakteriellen Creme abdecken.
Inhalation
Das Opfer sollte an einen kühlen Ort gebracht werden. Wenn es nicht atmet, sollte künstlich beatmet werden. Wenn das Atmen schwierig ist, geben Sie Sauerstoff.
Verschlucken
Wenn die Verbindung eingenommen wird, sollte kein Erbrechen ausgelöst werden, es sei denn, dies wird vom medizinischen Personal angeordnet. Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatte.
In allen Fällen sollte sofort ein Arzt aufgesucht werden (Sicherheitsdatenblatt Kaliumferrocyanid-Trihydrat, 2013)..
Anwendungen
1- Lebensmittelindustrie
Preußisches Gelb ist auch für seine zugelassene europäische Lebensmittelzusatzstoffnummer E536 bekannt und hat verschiedene Verwendungszwecke in der Lebensmittelindustrie. Es wird als Antibackmittel sowohl für Streusalz als auch für Speisesalz verwendet.
Es hat auch eine önologische Verwendung, um Kupfer und Eisen bei der Weinherstellung zu entfernen. Kupfer wird als Fungizid in Trauben verwendet (Universität Wageningen, 2014).
Es wird auch zur Fermentation von Zitronensäure verwendet (D. S. Clark, 1965). Kaliumferrocyanid kann auch als Dünger für Pflanzen verwendet werden.
2- Bergbau- und Metallurgieindustrie
Kaliumferrocyanid wird verwendet, um Kupfer aus Molybdänmineralien zu entfernen. Es wird auch zur Zementierung von Stahl verwendet (Kaliumferrocyanid, K4Fe (CN) 6, 2012)..
Zementierung ist eine thermochemische Behandlung von Stahlteilen. Der Prozess bringt Kohlenstoff durch Diffusion an die Oberfläche, der durch Modifizieren seiner Zusammensetzung imprägniert wird.
3- Laborreagenz
Kaliumferrocyanid wird verwendet, um die Konzentration von Kaliumpermanganat zu bestimmen, einer Verbindung, die häufig bei Titrationen auf der Basis von Redoxreaktionen verwendet wird..
Kaliumferrocyanid wird in einer Mischung mit Kaliumferricyanid und phosphatgepufferter Lösung verwendet, um einen Puffer für Beta-Galactosidase bereitzustellen, der zur Spaltung von X-Gal (5-Brom-4-chlor-3-indolyl-β-D-galactopyranosid) verwendet wird. eine hellblaue Visualisierung, in der ein an Beta-Gal konjugierter Antikörper (oder ein anderes Molekül) an sein Ziel gebunden hat.
Die Verbindung wird auch zur Herstellung von Preußischblau verwendet. Bei der Reaktion mit Fe (III) erhält es eine preußisch blaue Farbe, weshalb es in Laboratorien als Identifizierungsreagenz für Eisen verwendet wird..
Es wird auch zur Bestimmung von Zink in Zinksulfidproben verwendet. Die Probe wird in HCl 6 gelöstN. und unter einer Haube kochen, um Schwefelwasserstoff zu entfernen, mit Ammoniumhydroxid neutralisieren und 3 Tropfen HCl hinzufügen.
Zum Kochen bringen und 5 ml Lösung 1 hinzufügenN. von Kaliumferrocyanid. Das Vorhandensein eines weißen Zinkferrocyanid-Niederschlags zeigt einen positiven Test für dieses Element an (Mehlig, 1927)..
Verweise
- S. Clark, K. I. (1965). Einfluss von Kaliumferrocyanid auf die chemische Zusammensetzung von Melassepüree, das bei der Zitronensäurefermentation verwendet wird. Biotechnologie und Bioingenieurwesen Band 7, Ausgabe 2, 269-278. Von onlinelibrary.wiley.com wiederhergestellt.
- EMBL-EBI. (2008, 16. Januar). Kaliumhexacyanoferrat (4−). Von ebi.ac.uk wiederhergestellt.
- (2001, 5. März). POTASSIUM FERROCYANURE. Von laffort.com wiederhergestellt.
- Sicherheitsdatenblatt Kaliumferrocyanid-Trihydrat. (2013, 21. Mai). Von sciencelab.com wiederhergestellt.
- Mehlig, J. P. (1927). Verwendung von Kaliumferrocyanid als Bestätigungstest für Zink. Chem. Educ. 4 (6), 722. Von pubs.acs.org wiederhergestellt.
- Nationales Zentrum für Biotechnologie-Informationen… (2017, 15. April). PubChem Compound Database; CID = 161067. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Kaliumferrocyanid. (2017, 25. März). Von sciencemadness.org wiederhergestellt.
- Kaliumferrocyanid, K4Fe (CN) 6. (2012). Von atomistry.com wiederhergestellt.
- Royal Society of Chemistry. (2015). Kaliumferrocyanid. Von chemspider.com wiederhergestellt.
- Universität Wageningen. (2014, 14. August). E536: Kaliumferrocyanid. Von food-info.net wiederhergestellt.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.