
Hypoiodinsäure (HIO) Formel, Eigenschaften und Verwendungen

Das Hypoiodinsäure, auch als Wasserstoffmonoxoiodat (I) oder Iodol bekannt, ist es eine anorganische Verbindung der Formel HIO. Es ist eine Iodoxidsäure mit einem Sauerstoffatom, einem Wasserstoffatom und einem Iodatom mit einer Oxidationsstufe von 1+.
Die Verbindung ist sehr instabil, da sie dazu neigt, eine Dismutationsreaktion einzugehen, bei der sie zu molekularem Iod reduziert und gemäß der Reaktion zu Iodsäure oxidiert wird: 5HIO → 2Izwei + HIO3 + 2HzweiODER.
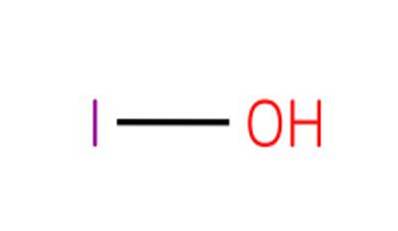
Die Verbindung ist die schwächste Säure der Halogenoxacide der Oxidationsstufe 1+. Die entsprechenden Salze dieser Säure sind als Hypoiodite bekannt.
Diese Salze sind stabiler als Säure und werden ähnlich wie ihre Gegenstücke aus Chlor und Brom gebildet, indem molekulares Iod mit Alkali- oder Erdalkalimetallhydroxiden umgesetzt wird..
Hypojodsäure wird hergestellt, indem molekulares Jod mit Quecksilber (II) -oxid (Egon Wiberg, 2001) gemäß der Reaktion umgesetzt wird:
2Izwei + 3HgO + H.zweiO → 2HIO + HgIzwei ● 2HgO
Spuren der Verbindung werden auch erhalten, indem molekulares Jod mit Kaliumhydroxid unter Bildung von zunächst Kaliumjodid und Kaliumhypoiodit gemäß der Reaktion umgesetzt wird:
ichzwei + 2KOH → KI + KIO
Hypoiodinsäure ist jedoch eine so schwache Säure, dass die Hydrolyse von Kaliumhypoiodit möglich ist, sofern nicht überschüssiges Kaliumhydroxid vorhanden ist (Holmyard, 1922)..
KIO + H.zweiO → HIO + KOH
Es kann ebenso wie seine Gegenstücke zu Chlor und Brom durch Umsetzen von molekularem Jod mit Wasser erhalten werden. Aufgrund seiner niedrigen Gleichgewichtskonstante, die in der Größenordnung von 10 liegt-13, die erhaltenen Mengen sind sehr gering (R.G. Compton, 1972).
Artikelverzeichnis
- 1 Physikalische und chemische Eigenschaften
- 2 Reaktivität und Gefahren
- 3 Verwendungen
- 4 Referenzen
Physikalische und chemische Eigenschaften
Hypoiodinsäure existiert nur als wässrige Lösung, die eine gelbliche Farbe hat. Die Verbindung im festen Zustand wurde nicht isoliert, daher werden die meisten ihrer Eigenschaften theoretisch durch rechnerische Berechnungen erhalten (Nationales Zentrum für Biotechnologie-Informationen, 2017)..
Hypoiodinsäure hat ein Molekulargewicht von 143,911 g / mol, einen Schmelzpunkt von 219,81 ° C, einen Siedepunkt von 544,27 ° C und einen Dampfdruck von 6,73 × 10-14 Millimeter Quecksilber.
Das Molekül ist in Wasser sehr gut löslich und kann sich zwischen 5,35 x 10 auflösen5 und 8,54 x 105 Gramm Verbindung pro Liter dieses Lösungsmittels (Royal Society of Chemistry, 2015).
HOI ist ein starkes Oxidationsmittel und kann explosive Gemische bilden. Es ist auch ein Reduktionsmittel und kann zu den Jod-, Jod- und periodischen Formen der Säure oxidiert werden. In wässrigen Lösungen dissoziiert es als schwache Säure teilweise in das Hypoiodit-Ion (OI)-) und H.+.
HOI reagiert mit Basen unter Bildung von Salzen, die als Hypoiodite bezeichnet werden. Beispielsweise wird Natriumhypoiodit (NaOI) durch Umsetzen von Hypoiodinsäure mit Natriumhydroxid gebildet..
HOI + NaOH → NaOI + H.zweiODER
Hypoiodinsäure reagiert auch leicht mit einer Vielzahl von organischen Molekülen und Biomolekülen..
Reaktivität und Gefahren
Hypoiodinsäure ist eine instabile Verbindung, die sich zu elementarem Jod zersetzt. Jod ist eine giftige Verbindung, die mit Vorsicht behandelt werden muss.
Hypoiodinsäure ist gefährlich bei Hautkontakt (reizend), bei Augenkontakt (reizend) sowie bei Verschlucken und Einatmen.
Überprüfen Sie bei Kontakt mit den Augen, ob Sie Kontaktlinsen tragen, und entfernen Sie diese sofort. Die Augen sollten mindestens 15 Minuten lang mit fließendem Wasser gespült werden, wobei die Augenlider offen bleiben sollten. Kaltes Wasser kann verwendet werden. Augensalbe sollte nicht verwendet werden.
Wenn die Chemikalie mit Kleidung in Kontakt kommt, entfernen Sie sie so schnell wie möglich, um Ihre eigenen Hände und Ihren Körper zu schützen. Stellen Sie das Opfer unter eine Sicherheitsdusche.
Wenn sich die Chemikalie auf der exponierten Haut des Opfers ansammelt, z. B. auf den Händen, wird die kontaminierte Haut vorsichtig und sorgfältig mit fließendem Wasser und nicht abrasiver Seife gewaschen. Kaltes Wasser kann verwendet werden. Bei anhaltender Reizung einen Arzt aufsuchen. Waschen Sie die kontaminierte Kleidung, bevor Sie sie erneut verwenden.
Bei starkem Hautkontakt sollte diese mit einer Desinfektionsseife gewaschen und die kontaminierte Haut mit einer antibakteriellen Creme abgedeckt werden..
Im Falle einer Inhalation sollte das Opfer in einem gut belüfteten Bereich ruhen dürfen. Wenn die Inhalation schwerwiegend ist, sollte das Opfer so bald wie möglich an einen sicheren Ort evakuiert werden. Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatte.
Wenn das Opfer Schwierigkeiten beim Atmen hat, sollte Sauerstoff verabreicht werden. Wenn das Opfer nicht atmet, wird eine Mund-zu-Mund-Beatmung durchgeführt. Denken Sie immer daran, dass es für die Person, die Hilfe leistet, gefährlich sein kann, eine Mund-zu-Mund-Beatmung durchzuführen, wenn das eingeatmete Material giftig, infektiös oder ätzend ist..
Bei Verschlucken kein Erbrechen herbeiführen. Lösen Sie enge Kleidung wie Hemdkragen, Gürtel oder Krawatten. Wenn das Opfer nicht atmet, führen Sie eine Mund-zu-Mund-Beatmung durch.
Suchen Sie in jedem Fall sofort einen Arzt auf..
Anwendungen
Hypoiodinsäure wird als starkes Oxidationsmittel und als Reduktionsmittel bei Laborreaktionen eingesetzt. Es wird verwendet, um chemische Verbindungen herzustellen, die als Hypoiodite bekannt sind..
Spektrophotometrische Methoden werden auch verwendet, um die Bildung von Hypoiodinsäure zu messen, um Reaktionen zu überwachen, an denen Jod beteiligt ist (T. L. Allen, 1955)..
Halogenide werden in Aerosole eingebaut, wo sie die katalytische Zerstörung von Ozon (O) beginnen3) über den Ozeanen und beeinflussen die globale Troposphäre. Zwei interessante Umweltprobleme, die derzeit erforscht werden, sind: Verständnis, wie molekulare Halogene in der reaktiven Gasphase direkt aus anorganischen Halogeniden hergestellt werden, die O ausgesetzt sind3 und beschränken Sie die Umweltfaktoren, die diesen Grenzflächenprozess steuern.
In der Arbeit von (Elizabeth A. Pillar, 2013) wurde die Umwandlung von Iodid in Hypoiodinsäure durch Einwirkung von Ozon durch Massenspektroskopiemessungen gemessen, um ein Modell des Ozonabbaus in der Atmosphäre zu bestimmen..
Verweise
- Egon Wiberg, N. W. (2001). Anorganische Chemie. London: Akademische Presse.
- Elizabeth A. Pillar, M. I. (2013). Umwandlung von Iodid in hypoiodische Säure und Iod in wässrigen Mikrotröpfchen, die Ozon ausgesetzt sind. Sci. Technol., 47 (19), 10971-10979.
- EMBL-EBI. (2008, 5. Januar). hypoiodische Säure. Von ChEBI abgerufen: ebi.ac.uk..
- Holmyard, E. (1922). Anorganische Chemie. London: Edwar Arnol & Co..
- Nationales Zentrum für Biotechnologie-Informationen… (2017, 22. April). PubChem Compound Database; CID = 123340. Von PubChem abgerufen.
- G. Compton, C. B. (1972). Reaktionen nichtmetallischer anorganischer Verbindungen. Ansterdam: Elsevier Verlag.
- Royal Society of Chemistry. (2015). Jod. Von chemspider.com abgerufen.
- L. Allen, R. M. (1955). Die Bildung von hypoiodischer Säure und hydratisiertem Iodkation durch Hydrolyse von Iod. J. Am. Chem. Soc., 77 (11) , 2957-2960.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.