
Borax Geschichte, Struktur, Eigenschaften, Verwendungen, Synthese, Risiken
Das Borax oder Natriumborat ist eine Bezeichnung für eine Gruppe chemischer Verbindungen mit einer Grundformel von NazweiB.4ODER7. Es ist ein hygroskopisches Salz, das zahlreiche Hydrate bilden kann und durch die Anwesenheit bestimmter metallischer Verunreinigungen strukturell angereichert wird.
Die Hauptverbindungen, die den Namen Borax erhalten, sind die folgenden: wasserfreies Natriumtetraborat, NazweiB.4ODER7;; Natriumtetraborat-Pentahydrat (NazweiB.4ODER7) .5HzweiODER; und Natriumtetraboratdecahydrat, NazweiB.4ODER7.10HzweiOder oder sein Äquivalent Natriumtetraborat-Octahydrat NazweiB.4ODER5(OH)4.8HzweiODER.

Wie zu erkennen ist, unterscheiden sich alle oben genannten Feststoffe nur in ihrem Hydratationsgrad; Einige haben mehr Wassermoleküle in ihren Kristallen als andere. Physisch sieht Borax aus wie robuste Stücke oder Kreidekristalle (oberes Bild).
Borax kommt natürlich in saisonalen Seesedimenten vor, die durch Verdunstung getrocknet werden. Borax wird in der Türkei, in Searles Lakes (Kalifornien), in der Atacama-Wüste, in Chile, Bolivien, Tibet und Rumänien hergestellt. Boraxkristalle können synthetisch durch einen langsamen Keimbildungsprozess erhalten werden; das heißt, eine, bei der das Wachstum von Kristallen begünstigt wird.
Natriumtetraborat, wasserfrei und decahydriert, ist in kaltem Wasser schwer löslich; aber seine Löslichkeit nimmt mit steigender Temperatur zu. Dann einzweiB.4ODER7.10HzweiOder es ist sehr gut löslich in Ethylenglykol, mäßig löslich in Ethanol und schwer löslich in Aceton; Dies sind weniger polare Lösungsmittel als Wasser.
Borax hat zahlreiche Anwendungen, beispielsweise bei der Herstellung von Waschmitteln und Seifen; als Feuerhemmer für Zellulosematerial; bei der Herstellung von Glasfaser; beim Reinigen von harten Oberflächen wie Metallen, Glas und Keramik; und unter anderem bei der Hemmung der Korrosion.
Borax reizt die Augen, die Haut und die Atemwege. Durch Verschlucken kann es unter anderem zu Erbrechen, Durchfall, Schlaffheit, Karies und Krampfanfällen kommen. Derzeit wird vermutet, dass es schädliche Auswirkungen auf die menschliche Fortpflanzung haben könnte.
Artikelverzeichnis
- 1 Geschichte
- 2 Struktur von Borax
- 3 Kristalle
- 3.1 Verwechslungen mit dem Boratanion
- 4 Eigenschaften
- 4.1 Namen
- 4.2 Molekularmasse
- 4.3 Aussehen
- 4.4 Dichte
- 4.5 Schmelzpunkt
- 4.6 Siedepunkt
- 4.7 Löslichkeit in Wasser
- 4.8 Löslichkeit in organischen Lösungsmitteln
- 4.9 Brechungsindex (ηD)
- 4.10 Stabilität
- 4.11 Lichtemission
- 4.12 Reaktionen
- 5 Verwendungen
- 5.1 Antioxidative Wirkung
- 5.2 Herstellung von Klebstoffen
- 5.3 Feuerhemmend
- 5.4 Herstellung von Borosilikatglas (Pyrex)
- 5.5 Emulgator
- 5.6 Reinigungsmaterial
- 5.7 Medizinische Anwendungen
- 5,8 pH-Puffer
- 5.9 Abnahme der Wasserhärte
- 5.10 Dünger und Kompost
- 5.11 Holzschutz
- 5.12 Flussmittel und Flussmittel
- 5.13 Andere
- 6 Synthese
- 7 Risiken
- 8 Referenzen
Geschichte
Die Geschichte von Borax ist verwirrend. Es wird gesagt, dass es im Bett eines Sees in Tibet entdeckt wurde, das durch Verdunstung ausgetrocknet ist. Es wurde im 8. Jahrhundert von Tibet nach Saudi-Arabien über die sogenannte Seidenstraße verlegt.
Der Begriff "Borax" wurde aufgrund der zahlreichen Anwendungen populär, die unter dem Namen 20 Mule Team Borax Tradermax gefunden und vermarktet wurden und sich auf die Art und Weise bezogen, wie Borax durch die Wüsten von Nevada und Kalifornien transportiert wurde.
Eine andere Version seiner Entdeckung weist darauf hin, dass die Ägypter lange von seiner Existenz wussten und es beim Schweißen von Metallen durch Hitze verwendeten. Darüber hinaus verwendeten sie es in der Medizin und im Mumifizierungsprozess. Borax wurde im 13. Jahrhundert von Marco Polo nach Europa transferiert.
Mitte des 19. Jahrhunderts wurden in der Mogave-Wüste große Boraxvorkommen entdeckt, die seitdem allgemein verwendet werden..
Struktur von Borax

Das obere Bild zeigt die Ionen, aus denen Borax besteht, die speziell einem Feststoff mit einer Zusammensetzungsformel von Na entsprechenzwei[B.4ODER5(OH)4] · 8HzweiO (oder NazweiB.4ODER710HzweiODER).
Erstens die Käfigstruktur des Anions [B.4ODER5(OH)4]]zwei- (obwohl es zwei deprotonierte -OH-Gruppen haben sollte, -O-), in dem ein achteckiger Ring (vier B- und vier O-Atome) zu sehen ist, der durch eine B-O-B-Brücke in zwei Hälften geteilt wird.
Der Käfig bleibt nicht statisch, sondern vibriert und nimmt im Raum unterschiedliche Formen an. in geringerem Maße jedoch in der Nähe der Brücke. Es kann auch festgestellt werden, dass es sehr "sauerstoffhaltig" ist; Das heißt, es hat viele Sauerstoffatome, die über Wasserstoffbrücken mit Wassermolekülen interagieren können.
Es ist daher nicht überraschend, dass Boraxkristalle hydratisieren und zahlreiche Hydrate erzeugen können. Somit ist für das feste Nazwei[B.4ODER5(OH)4] · 8HzweiOder es gibt acht Moleküle von H.zweiOder mit dem Boratkäfig und gleichzeitig mit den Metallzentren von Na interagieren+.
Auf der Kationenseite haben wir den wässrigen Komplex [Na (H.zweiODER)4]]+n, wobei der Wert von n vom Anion / Kation-Verhältnis abhängt. Im oberen Festkörper ist n = 2, also haben wir: [Nazwei(H.zweiODER)8]]zwei+, deren 2+ -Ladung neutralisiert die 2-Ladung des Boratanions.
Kristalle
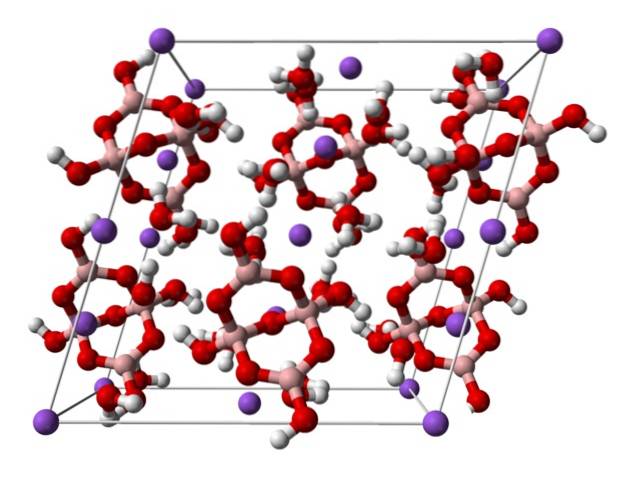
Domain].
Oben ist die monokline Einheitszelle für Na-Kristalle dargestelltzwei[B.4ODER5(OH)4] · 8HzweiO oder NazweiB.4ODER710HzweiO. Hier beherrschen oder dominieren elektrostatische Anziehungskräfte und Wasserstoffbrückenbindungen die Strukturmuster, die in jeder Spannweite des Kristalls entstehen..
Die anderen Hydrate und das wasserfreie Salz verlieren eines oder alle ihrer Wassermoleküle und verändern die Zusammensetzung und Struktur des Boraxkristalls. In allen von ihnen bleiben Anion und Kation gleich (es sei denn, es gibt Verunreinigungen oder Nebenreaktionen), so dass diesbezüglich keine Verwirrung bestehen kann..
Verwechslungen mit dem Boratanion
N / Azwei[B.4ODER5(OH)4] · 8HzweiO und NazweiB.4ODER710HzweiOder sie sind gleich. Warum?
Erstens, wenn Sie seine Atome zählen, wird man sehen, dass sie in der Anzahl zusammenfallen; und zweitens im Anion B.4ODER7zwei- das Fehlen der beiden OH-Gruppen, die an die Borköpfe der B-O-B-Brücken gebunden sind, wird berücksichtigt; zwei OH, die zusammen mit den beiden H.+ kommt aus B.4ODER7zwei-, 2 H hinzufügenzweiOder geben Sie insgesamt 10 H.zweiOder (8 + 2).
Eigenschaften
Namen
- Borax.
- Natriumborat.
- Natriumtetraborat.
- Dinatriumtetraborat.
Molekulare Masse
Wasserfrei: 201,22 g / mol.
Decahydrat: 381,38 g / mol.
Aussehen
Ein weißer kristalliner Feststoff.
Dichte
Wasserfrei: 2,4 g / cm3
Decahydrat: 1.739 g / cm3
Schmelzpunkt
Wasserfrei: 743 ° C (1.036 K).
Decahydrat: 75 ºC.
Siedepunkt
Wasserfrei: 1.575ºC (2.867ºF, 1.848 K).
Wasserlöslichkeit
31,78 g / l (sowohl für wasserfreies als auch für Decahydrat).
Löslichkeit in organischen Lösungsmitteln
Es ist in Ethylenglykol sehr gut löslich, in Diethylenglykol und Methanol mäßig löslich und in Aceton schwer löslich..
Brechungsindex (ηD)
Wasserfrei: η1 = 1.447; ηzwei = 1,469.
Decahydrat: ηzwei = 1.472.
Stabilität
Es ist unter geeigneten Lagerbedingungen stabil. Obwohl es einen niedrigen Dampfdruck hat, steigt es mit der Temperatur an, was zu Kristallisation und Kondensation führt. Daher sollten übermäßige Schwankungen der Temperatur und Luftfeuchtigkeit vermieden werden..
Lichtemission
Natriumtetraborat, wenn es der Einwirkung von Feuer ausgesetzt wird, gibt grünes Licht ab.
Reaktionen
- Wenn es sich in Wasser löst, entstehen alkalische Lösungen mit einem pH-Wert von etwa 9,2.
- Borax reagiert unter Bildung anderer Borate wie Perborat (PBS).
- Es erzeugt auch Borsäure durch Reaktion mit Salzsäure:
N / AzweiB.4ODER710HzweiO + HCl => 4 H.3BO3 + 2 Na+ + 2 Cl- + 5 hzweiODER
- Natriumtetraborat verhält sich wie eine amphotere Substanz, da es in wässriger Lösung hydrolysiert und Säuren neutralisieren kann. Auf die gleiche Weise ist es in der Lage, hochkonzentrierte Alkalien zu neutralisieren, wodurch ein übermäßiger Anstieg des pH-Werts des Mediums vermieden wird..
Anwendungen
Borax hat zahlreiche Anwendungen, sowohl beim Menschen als auch bei allen Aktivitäten, die er ausführt..
Antioxidative Wirkung
Borax hat die Fähigkeit, Oxide aufzulösen. Aus diesem Grund wird es zur Rückgewinnung von Metallen wie Messing, Kupfer, Blei und Zink verwendet..
Es wird auch verwendet, um die Oxidation von Metallstäben in Gießereien zu verhindern. Borax bedeckt seine Oberfläche ohne Luft und verhindert so die Oxidation. Darüber hinaus verhindert es die Korrosion von Eisenwerkstoffen im Automobilbau.
Die Löslichkeit von Borax in Ethylenglykol war in Frostschutzformulierungen nützlich. Borax neutralisiert die sauren Rückstände, die bei der Zersetzung von Ethylenglykol entstehen, und minimiert so die Oxidation, die die Oberfläche von Metallen erfahren kann.
Herstellung von Klebstoffen
- Borax ist Teil einer Stärkeklebstoffformulierung für Wellpappe und Pappe.
- Es ist ein Peptisierungsmittel bei der Herstellung von Klebstoffen auf der Basis von Kasein und Dextrin.
- Es verstärkt Klebstoffe durch Vernetzung konjugierter Hydroxylgruppen.
Feuerdämmend
Es wird als Flammschutzmittel in Cellulosematerialien und anderen Polymeren verwendet, die Hydroxylgruppen enthalten. Es übt seine Wirkung durch verschiedene Mechanismen aus, einschließlich der Bildung einer Glasschicht, die den Zugang von Kraftstoffen einschränkt.
Herstellung von Borosilikatglas (Pyrex)
Borax ist eine Borquelle, die bei der Herstellung von Borosilikatglas verwendet wird. gekennzeichnet durch einen hohen Schmelzpunkt, einen niedrigen Ausdehnungskoeffizienten und eine hohe Beständigkeit gegen Thermoschock.
Dies ermöglicht es, hohen Temperaturen ausgesetzt zu werden, ohne dass es zu Brüchen kommt, und erhält den Namen feuerfestes Glas..
Borosilikatglas wird zur Herstellung von Materialien verwendet, die zu Hause zum Backen von Lebensmitteln verwendet werden sollen. Es wird auch in Labors in Bechern, Kolben, Messzylindern, Pipetten usw. verwendet..
Emulgator
Borax wird zusammen mit anderen Verbindungen verwendet, um Seifen und andere Paraffine zu emulgieren. Es wird auch als Basis für die Herstellung von Lotionen, Cremes und Salben verwendet..
Reinigungsmittel
- Es wird in Formulierungen hinzugefügt, um feste Oberflächen wie Metalle, Glas und Keramik zu reinigen.
- Es wird in Handreinigern, Poliermaterialien und Waschmittelseifen für Wäschereien und zu Hause verwendet. Darüber hinaus erleichtert es die Entfernung von öligen Ablagerungen aus den Fabrikhallen.
Medizinische Anwendungen
- Es wird zur Behandlung von Pilzinfektionen der Füße eingesetzt.
- Es ist Teil der Nährstoffformel, die Bor liefert. Es wird angenommen, dass dieses Element am Metabolismus von Kalzium, Phosphor und Magnesium beteiligt ist und für die Knochenstruktur notwendig sein kann.
- Es ist an der Bestimmung von glykosyliertem Hämoglobin (HbA1C) beteiligt, einem Test, der zur Bestimmung der langfristigen Entwicklung von Diabetes bei einem Patienten dient, da die Halbwertszeit eines Erythrozyten 120 Tage beträgt.
Diese Informationen sind für den Kliniker nützlicher als einzelne Blutzuckermessungen des Patienten..
PH-Puffer
Es wird in verschiedenen Puffersystemen verwendet, die in der Biochemie verwendet werden. unter ihnen Tris (hydroxymethyl) aminomethanborat, das bei der Polyacrylamidelektrophorese von DNA- und RNA-Nukleinsäuren verwendet wird.
Abnahme der Wasserhärte
Borax kann sich mit den im Wasser vorhandenen Calcium- und Magnesiumionen verbinden und deren Konzentration verringern. Auf diese Weise wird die Härte des Wassers verringert.
Dünger und Kompost
Borax wird als Borquelle verwendet. Calcium und Bor sind an der Bildung der Pflanzenzellwand beteiligt. Darüber hinaus wurde darauf hingewiesen, dass Bor die Bestäubung begünstigt, weshalb es in die Düngung und Vermehrung von Pflanzen eingreift.
Holzschutz
Borax bekämpft Holzwürmer, einen Käfer, der Holz verbraucht und zerstört. Es wird auch zur Konservierung und Wartung von Holzbooten verwendet.
Fluss und Fluss
Es wird als Flussmittel beim Schweißen von Stahl und Eisen verwendet, wodurch der Schmelzpunkt gesenkt und Eisenoxid beseitigt wird. eine unerwünschte Verunreinigung. Zu einem ähnlichen Zweck beteiligt er sich am Löten von Gold und Silber.
Andere
- Es wird als mildes Pestizid verwendet; Zum Beispiel, um Motten auf Wolle zu bekämpfen.
- Das Sprühen wird zur Bekämpfung von Schädlingen eingesetzt, die in Schränken, Innentanks, in den Hohlräumen der Wände und im Allgemeinen dort vorhanden sind, wo die Verwendung umweltschädlicherer Pestizide nicht erwünscht ist..
- Es wird in Kernreaktoren verwendet, um Reaktionen zu steuern, die im Extremfall eine Kettenreaktion hervorrufen können.
- In Autokühlern wird Borax verwendet, um Stellen zu blockieren, an denen Wasser austritt.
Synthese
Borax wird durch Umsetzen des Minerals Ulexit, bestehend aus den Elementen Bor, Natrium und Calcium, mit der Formel NaCaB erhalten5ODER9.8HzweiOder mit Natriumcarbonat und Natriumhydrocarbonat in wässrigem Medium.
Tatsächlich wird die Synthese von Natriumtetraborat oder Borax wenig genutzt; Der größte Teil der hergestellten Verbindung wird durch Extraktion der Mineralien gewonnen, die sie enthalten.
Das Verfahren kann in einer Auflösung des Erzes in Wasser zusammengefasst werden, gefolgt von einer Filtration in Ton und schließlich einer Verdampfung der wässrigen Lösung.
Risiken
Borax ist ein Naturprodukt, kann jedoch eine Reihe von Schäden für die menschliche Gesundheit verursachen. Beispielsweise kann der Kontakt mit Boraxpulver Hautreizungen verursachen, die zu Dermatitis führen können..
In ähnlicher Weise verursacht Borax eine Reizung der Augen und der oberen Atemwege. Symptome der Inhalation sind Husten und Halsschmerzen.
Währenddessen zeigt die Einnahme von Borax die folgenden Symptome: Erbrechen, Übelkeit, Durchfall, Schlaffheit, Kopfschmerzen und Krampfanfälle. Darüber hinaus können das Zentralnervensystem und die Nierenfunktion beeinträchtigt werden..
Aus Studien an männlichen Ratten, die mit Borax gefüttert wurden, wurde bei ihnen eine Hodenatrophie beobachtet. Während Studien an trächtigen weiblichen Ratten zeigten, dass Borax die Plazenta passieren könnte, was zu einer Veränderung der fetalen Entwicklung führt, die sich in einem geringen Geburtsgewicht äußert.
Es wird angenommen, dass die Exposition gegenüber Borax die männliche Fortpflanzungsfunktion bei Männern beeinträchtigt, was sich in einer Verringerung der Spermienzahl äußert.
Eine tödliche Dosis von 10 bis 25 Gramm wird für die Boraxaufnahme bei Erwachsenen geschätzt.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Argon. PubChem-Datenbank. CID = 23968. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Karolyn Burns, Seneca Joseph und Dr. Ryan Baumbach. (s.f.). Synthese und Eigenschaften von Boraxkristallen und intermetallischen Legierungen. Wiederhergestellt von: nationalmaglab.org
- Wikipedia. (2019). Borax. Wiederhergestellt von: en.wikipedia.org
- Rio Tinto. (2019). Borax decahydrate. 20 Maultier Team Borax. Wiederhergestellt von: borax.com
- Fletcher Jenna. (14. Januar 2019). Ist Borax sicher zu verwenden? Wiederhergestellt von: medicalnewstoday.com



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.