
Struktur, Eigenschaften, Verwendungen von Natriumborhydrid (NaBH4)

Das Natriumborhydrid ist ein anorganischer Feststoff, dessen chemische Formel NaBH ist4. Es kann als repräsentativ für die Alkaliborhydride angesehen werden und ist das häufigste davon. Es ist ein weißer kristalliner Feststoff.
Bei Kontakt mit Wasser NaBH4 kann Wärme und Wasserstoff H erzeugenzwei Das ist brennbar und muss daher mit Vorsicht behandelt werden. Wegen der Leichtigkeit, mit der es Hydridionen H erzeugen kann-, Natriumborhydrid ist eine mäßig reduzierende Verbindung, daher wird es zu diesem Zweck häufig in chemischen Reaktionen verwendet.

Seine reduzierende Eigenschaft wird auch in der Papierindustrie eingesetzt, da es die Helligkeits- und Stabilitätseigenschaften von Zellstoff und Papier verbessert, indem es der Oxidation von Cellulose, dem Hauptbestandteil von Papier, entgegenwirkt..
Da es in Gegenwart von Wasser leicht Wasserstoff bilden kann, wurde auch die Möglichkeit untersucht, es als reversible Wasserstoffquelle in Brennstoffzellen zu verwenden..
Es hat andere Verwendungszwecke, die alle auf seiner reduzierenden Eigenschaft beruhen, beispielsweise in der pharmazeutischen Industrie.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Physikalische Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Selbstentzündungstemperatur
- 3.4 Zersetzungstemperatur
- 3.5 Dichte
- 3.6 Löslichkeit
- 4 Chemische Eigenschaften
- 5 Risiken
- 6 Erhalten
- 7 Verwendungen
- 7.1 Bei reduktionschemischen Reaktionen
- 7.2 Bei der Herstellung von H2 in Brennstoffzellen
- 7.3 In der Zellstoff- und Papierindustrie
- 7.4 In verschiedenen Anwendungen
- 8 Referenzen
Struktur
Natriumborhydrid ist eine ionische Verbindung. Es wird durch das Borhydridanion [BH4]]- an das Natriumkation Na gebunden+.
Das Anion [BH4]]- ist tetraedrisch.
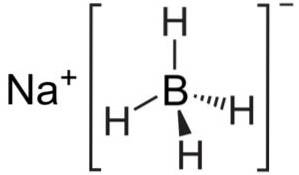
Seine Lewis-Struktur ist wie folgt:
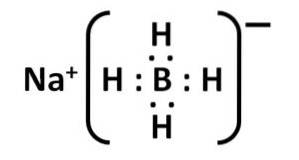
Nomenklatur
-Natriumborhydrid
-Natriumtetrahydroborat
-Natriumtetrahydruroborat
Physikalische Eigenschaften
Körperlicher Status
Festes weißes kristallines.
Molekulargewicht
37,84 g / mol
Selbstentzündungstemperatur
∼ 220 ºC
Zersetzungstemperatur
> 250 ºC
Dichte
1,074 g / cm3 bei 20 ºC
Löslichkeit
Das NaBH4 es ist in Wasser gut löslich (55 g / 100 ml bei 25 ºC), wo es teilweise hydrolysiert wird. Es ist in Tetrahydrofuran (THF) löslich und in Diethylether unlöslich.
Chemische Eigenschaften
Natriumborhydrid löst sich in Wasser, wo es anfänglich zersetzt oder hydrolysiert wird, wodurch die Lösung basisch wird und eine weitere Hydrolyse verhindert wird..
[BH4]]- + H.zweiO → B (OH)3 + H.zwei↑ + OH-
Dies wird erklärt, weil die [BH4]]- interagiert mit dem H.+ vom Wasser, wo die H.+ nimmt ein Hydridanion H.- zu bilden H.zwei. Man kann sagen, dass der BH3 konkurrieren mit dem H.+ durch das Hydridion H.-.
In einem sauren Medium ist die Hydrolyse aufgrund der Fülle an H-Ionen vollständig+.
Das NaBH4 es ist in trockener Luft stabil. Es ist nicht flüchtig.
Natriumborhydrid ist aufgrund seines Gehalts an Hydridionen eine reduzierende Verbindung. Es ermöglicht die Reduktion der Carbonylgruppe C = O zu C-OH, dh Carbonylverbindungen zu Alkoholen.
Das NaBH4 An sich reduziert es nicht die C = C-Doppelbindungen, auch nicht die mit Carbonylgruppen konjugierten -C = C-C (= O)-.
Bei Kontakt mit Protonensäuren (wie HCl) oder Lewis-Säuren (wie BCl)3 oder AlCl3) Diboran B wird gebildetzweiH.6. Und wenn diese Reaktion in Gegenwart von organischen Verbindungen mit C = C-Doppelbindungen durchgeführt wird, Diboran B.zweiH.6 führt die Hydroborierung dieser durch.
In Gegenwart geeigneter Katalysatoren und spezifischer Bedingungen kann Natriumborhydrid verschiedene Arten von funktionellen Gruppen reduzieren.
Risiken
Die Wärme der Hydrolysereaktion in Wasser reicht aus, um den darin gebildeten Wasserstoff zu entzünden. Daher ist beim Umgang damit Vorsicht geboten.
Das NaBH4 es ist leicht zu entzünden und brennt leicht.
Erhalten
Die typische NaBH-Präparationsreaktion4 erfolgt durch Natriumhydrid NaH und B (OCH3)3 bei einer Temperatur von ca. 250 ºC:
4 NaH + B (OCH3)3 → NaBH4 + 3 NaOCH3
Anwendungen
Bei der Reduktion chemischer Reaktionen
Weil es eine Quelle für H-Ionen ist-, das NaBH4 Es ist eine reduzierende Verbindung und wird zur Herstellung anderer chemischer Verbindungen verwendet. Hierzu wird es in aprotischen polaren Lösungsmitteln eingesetzt, also ohne H-Protonen+, wie Dimethylsulfoxid, Hexamethylphosphoramid und Dimethylformamid.
Es wird als Reduktionsmittel sowohl bei organischen als auch bei anorganischen chemischen Reaktionen verwendet..
Es ermöglicht die Reduktion von Aldehyden zu primären Alkoholen und von Ketonen zu sekundären Alkoholen.
Es reduziert auch Alkylhalogenide zu Kohlenwasserstoffen wie Iododecan zu Decan, Bromoundecansäure zu Undecansäure und Chlordodecan zu Dodecan..
Wenn es alleine wirkt, beeinflusst es bei der Durchführung der Reduktion andere funktionelle Gruppen wie Ester, Carbonsäure, Nitril und Sulfon nicht.
Seine Eigenschaft, C = C-Doppelbindungen nicht zu reduzieren, auch nicht solche, die mit Carbonylgruppen -C = C-C (= O) konjugiert sind, ermöglicht die Herstellung ungesättigter Alkohole -C = C-CHzwei-Oh.
Um nitrierte aromatische Verbindungen zu ihren entsprechenden Anilinen zu reduzieren, müssen Katalysatoren wie Kobalt oder Zinnchlorid vorhanden sein. Reduziert Disulfide zu Thiolen.
In Gegenwart geeigneter Bedingungen und Katalysatoren können Carbonsäuren, Ester, Amide, Nitrile, Imine, Epoxide und sogar Doppel- und Dreifachbindungen reduziert werden.
Bei der Herstellung von H.zwei in Brennstoffzellen
Das NaBH4 kann in eine Brennstoffzelle umgewandelt werden.
Das NaBH4 in Gegenwart einer alkalischen Lösung von KOH oder NaOH hydrolysiert es und erzeugt Wasserstoff H.zwei welches als Brennstoff in einer Polymerelektrolyt-Brennstoffzelle verwendet werden kann.
Es wurde auch als Speichermaterial für H untersuchtzwei reversibel.
NaBH-Nanopartikel werden synthetisiert4 und mit einem Tensid stabilisiert. Nach der Behandlung mit NiClzwei Es wird eine Schutzschicht oder Beschichtung gebildet, die die Freisetzung von H reguliertzwei vollständig reversibel.
Dieses neue nanometrische Material würde die Verwendung von H ermöglichenzwei als sauberer und erneuerbarer Kraftstoff.

In der Zellstoff- und Papierindustrie
Natriumborhydrid wird verwendet, um den Glanz und andere physikalische Eigenschaften von Zellstoff und Papier zu verbessern..
Der Abbau der Cellulosematrix des Papiers erfolgt durch komplexe Prozesse, die eine Oxidation beinhalten. Hydroxylgruppen werden zu Carbonyl und Carboxyl oxidiert, was zu Verfärbungen des Papiers und einer Abnahme seiner physikalischen Eigenschaften führt..
Bei der Behandlung von Zellstoff oder Papier mit NaBH4, Dies reduziert Aldehyde und Ketone zu -OH-Gruppen, ohne die sauren Carbonsäuregruppen zu beeinflussen, wodurch die Stabilität und der Glanz bei höheren als den Anfangswerten verbessert werden..

In verschiedenen Anwendungen
Natriumborhydrid wird zur Behandlung von Abwasser als geschmacksverstärkendes Mittel in der Lebensmittel- und Getränkeindustrie, als Beschichtungsmittel und zur Oberflächenbehandlung bei der Tabakherstellung in der Pharma-, Textil- und Industrieindustrie verwendet. Leder.
Verweise
- Christian, M.L. und Aguey-Zinsou, K.-F. (2012). Core-Shell-Strategie führt zu hoher reversibler Wasserstoffspeicherkapazität für NaBH4. ACS Nano 2012, 6, 9, 7739-7751. Von pubs.acs.org wiederhergestellt.
- Nora de Souza, M.V. und Alves V., T.R. (2006). Neuere Methoden, die durch Natriumborhydrid bei der Reduktion verschiedener Verbindungsklassen vermittelt werden. App. Organometall. Chem. 2006; 20: 798 & ndash; 810. Von onlinelibrary.wiley.com wiederhergestellt.
- Imamoto, T. (1991). Die Ermäßigung. Natriumborhydrid. In der umfassenden organischen Synthese. Von sciencedirect.com wiederhergestellt.
- Tang, L.C. (1986) Stabilisierung von Papier durch Natriumborhydridbehandlung. In historischen Textil- und Papiermaterialien. Kapitel 24. Seiten 427-441. Fortschritte in der Chemie, Band 212. Von pubs.acs.org wiederhergestellt.
- Cotton, F. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene Anorganische Chemie. Vierte Edition. John Wiley & Sons.
- Morrison, Robert Thornton; und Boyd, Robert Neilson. 1992. Organische Chemie. Prentice-Hall. ISBN 81-203-0765-8.
- UNS. Nationalbibliothek für Medizin. (2019). Natriumborhydrid. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.