
Eigenschaften, Struktur, Verwendung, Risiken von Calciumoxalat (CaC2O4)
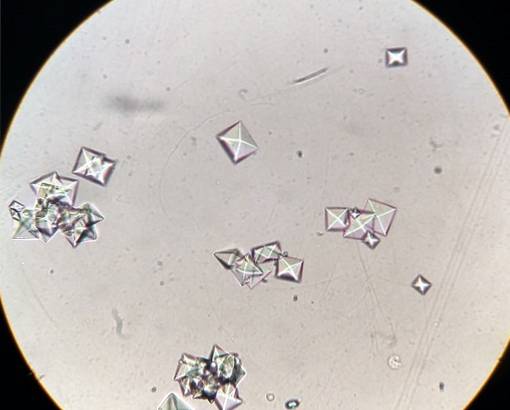
Das Kalziumoxalat Es ist eine organische Verbindung, die aus den Elementen Kohlenstoff (C), Sauerstoff (O) und Calcium (Ca) besteht. Seine chemische Formel lautet CaCzweiODER4. Es kommt im Allgemeinen in seinen drei hydratisierten Formen vor: Mono-, Di- und Trihydrat. Das heißt, mit einem, zwei oder drei Wassermolekülen in seiner kristallinen Struktur..
Calciumoxalat kommt in Mineralien, Pflanzen, Pilzen und anderen Lebewesen wie Säugetieren und sogar beim Menschen als Folge des Metabolismus einiger Proteine vor. Es kann im Urin von Menschen und einigen Tieren gefunden werden.
Einige Lebensmittel wie Spinat, Rhabarber, Soja und Schokolade enthalten viele Oxalate, und wenn empfindliche Menschen sie essen, können sich in ihren Nieren Calciumoxalatsteine bilden..
CaC-Steine können verhindert werdenzweiODER4 in den Nieren, wenn sie viel Flüssigkeit, insbesondere Wasser, aufnehmen, oxalatreiche Lebensmittel meiden und kalzium- und magnesiumreiche Lebensmittel konsumieren.
Calciumoxalat bildet unerwünschte Ablagerungen in Rohren und Tanks bei Prozessen wie der Zellstoff- und Papierherstellung und auch in Brauereien.
Artikelverzeichnis
- 1 Struktur
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalischer Zustand
- 3.2 Molekulargewicht
- 3.3 Schmelzpunkt
- 3.4 Spezifisches Gewicht
- 3.5 Löslichkeit
- 3,6 pH
- 3.7 Chemische Eigenschaften
- 4 Präsenz in der Natur
- 4.1 In Mineralien
- 4.2 In Pflanzen und Pilzen
- 5 Präsenz im menschlichen Körper und bei Säugetieren
- 5.1 Beim Menschen
- 5.2 Faktoren, die das Erscheinungsbild von Steinen in den Nieren beeinflussen
- 5.3 Möglichkeiten zur Vermeidung der Bildung von Calciumoxalatsteinen
- 5.4 Bei Tieren
- 5.5 Körperreaktion auf überschüssiges Oxalat
- 6 Verwendungen
- 6.1 Probleme in einigen Prozessen
- 7 Risiken
- 8 Referenzen
Struktur
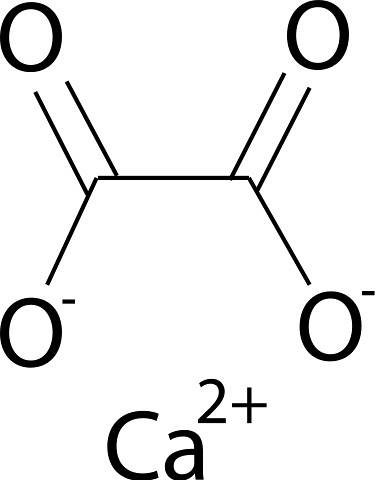
Calciumoxalat wird durch das Calciumion Ca gebildetzwei+ und das Oxalation C.zweiODER4zwei-. Das Oxalatanion besteht aus zwei Kohlenstoffatomen und vier Sauerstoffatomen. Die negativen Ladungen des Oxalatanions befinden sich an den Sauerstoffatomen.
Nomenklatur
- Kalziumoxalat
- Oxalsäure-Calciumsalz
- Ethandisäure-Calciumsalz
Eigenschaften
Körperlicher Status
Farbloser, weißer, gelber oder brauner kristalliner Feststoff, der in drei verschiedenen hydratisierten Formen vorliegen kann.
Molekulargewicht
128,1 g / mol
Schmelzpunkt
Calciumoxalatmonohydrat zersetzt sich bei 200 ° C..
Bestimmtes Gewicht
Monohydrat CaCzweiODER4 •H.zweiO = 2,22 g / cm3
Dihydrat CaCzweiODER4 •2HzweiO = 1,94 g / cm3
Trihydrat CaCzweiODER4 •3HzweiO = 1,87 g / cm3
Löslichkeit
In Wasser fast unlöslich: 0,00061 g / 100 g Wasser bei 20 ° C. Monohydrat löst sich in verdünnter Säure.
pH
Wässrige Lösungen von Calciumoxalat sind schwach basisch.
Chemische Eigenschaften
Calciumoxalat ist das Calciumsalz der Oxalsäure. Dies ist ein natürliches Nebenprodukt des Stoffwechsels, daher kommt es im menschlichen Körper sehr häufig vor und ist Teil vieler Lebensmittel.
Oxalsäure und ihre konjugierte Base Oxalat sind hochoxidierte organische Verbindungen mit starker Chelatisierungsaktivität, dh sie können sich leicht mit positiven Ionen mit Ladungen von +2 oder +3 verbinden.
Seine wässrigen Lösungen sind schwach basisch, da das Oxalation dazu neigt, H-Protonen aufzunehmen.+ aus Wasser, das OH-Ionen freisetzt-. Nach der Einnahme von zwei Protonen H.+ Das Oxalation wird zu Oxalsäure H.zweiC.zweiODER4::
C.zweiODER4zwei- + H.zweiO → HCzweiODER4- + Oh-
HCzweiODER4- + H.zweiO → H.zweiC.zweiODER4 + Oh-
Präsenz in der Natur
In Mineralien
Calciumoxalat ist das häufigste Oxalat und kommt in Form der Mineralien Whewellit, Weddellit und Caoxit vor..
Whewellite ist das Monohydrat CaCzweiODER4 •H.zweiOder und ist die stabilste Form dieser Verbindung.

Weddellit ist das Dihydrat CaCzweiODER4 •2HzweiO und ist weniger stabil als Monohydrat.

Caoxit ist Calciumoxalat-Trihydrat CaCzweiODER4 •3HzweiODER.
In Pflanzen und Pilzen
Calciumoxalat wird in Verbindung mit trockenen Böden und Blättern gefunden, auch mit pathogenen Pilzen, frei, in Symbiose oder in Verbindung mit Pflanzen. In letzterem werden Kristalle durch Ausfällung von Calcium in Form seines Oxalats gebildet..
CaC-BildungzweiODER4 durch Pilze hat einen wichtigen Einfluss auf die biologischen und geochemischen Prozesse von Böden, da es eine Kalziumreserve für das Ökosystem darstellt.
Präsenz im menschlichen Körper und bei Säugetieren
Oxalat stammt aus der Leber, aus roten Blutkörperchen oder Erythrozyten und in geringerem Maße aus der Niere. Es entsteht aus dem Metabolismus von Aminosäuren (wie Phenylalanin und Tryptophan) und durch Oxidation von Glyoxaldialdehyd,.
Auch Vitamin C kann bei Ausübung seiner antioxidativen Funktion in Oxalat umgewandelt werden.
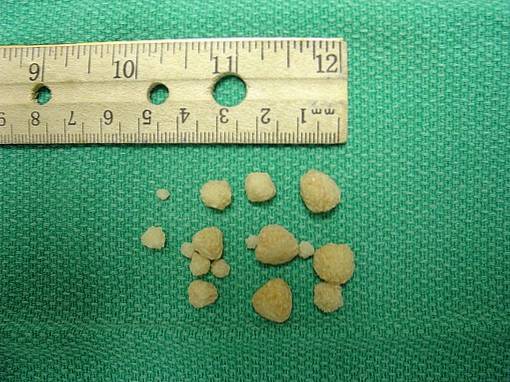
Calciumoxalat kommt in Steinen vor, die sich in den Nieren von Menschen oder Tieren mit Nierenerkrankungen bilden..
Die sogenannten Calciumoxalatsteine oder -steine werden durch Kristallisation oder Aggregation von CaC gebildetzweiODER4 im mit Calcium und Oxalat übersättigten Urin. Dies bedeutet, dass der Urin so viel Calcium und Oxalat enthält, dass es nicht möglich ist, dass diese Verbindung gelöst bleibt, sondern in Form von Kristallen ausfällt oder in den festen Zustand übergeht..
In Menschen
Die Bildung von Körnern oder Steinen in den Nieren ist eine Krankheit, die als Nephrolithiasis bezeichnet wird. Angriffe etwa 10% der Bevölkerung und etwa 75% dieser Steine bestehen aus Calciumoxalat CaCzweiODER4.
Die Bildung und das Wachstum von Calciumoxalatkristallen in der Niere treten auf, weil bei einigen Menschen der Urin mit diesem Salz übersättigt ist. Calciumoxalat entwickelt sich im sauren Urin bei einem pH-Wert von weniger als 6,0.
Übersättigung tritt auf, wenn die Ausscheidung oder Eliminierung dieses Salzes (das in Wasser sehr schlecht löslich ist) im Urin in einem kleinen Wasservolumen erfolgt..
Faktoren, die das Erscheinungsbild von Steinen in den Nieren beeinflussen
Zu den Faktoren, die die Bildung von Calciumoxalatkorn begünstigen, gehören überschüssiges Calcium im Urin oder Hypercalciurie, überschüssiges Oxalat im Urin oder Hyperoxalurie, aus der Nahrung stammende Elemente und das Fehlen von Inhibitoren.
Überschüssiges Oxalat kann auftreten, wenn unter anderem große Mengen Spinat, Rhabarber, Soja, Nüsse und Schokolade gegessen werden..

Es gibt jedoch Substanzen, die das Auftreten von Steinbildung hemmen oder verhindern. Zu den Verbindungen, die die Steinbildung verhindern, gehören kleine Moleküle wie Citrat und Pyrophosphat sowie große Moleküle wie Glykoproteine und Proteoglykane..
Möglichkeiten zur Vermeidung der Bildung von Calciumoxalatsteinen
Eine gute Strategie, um das Wiederauftreten von Sand- oder Kalziumoxalatsteinen zu verhindern, besteht darin, die Flüssigkeitsaufnahme zu erhöhen, die Aufnahme von kalziumreichen Lebensmitteln (wie Milchprodukten) zu erhöhen und das Speisesalz (NaCl), tierisches Eiweiß und oxalatreiche Lebensmittel einzuschränken.
Bei Tieren
Seit Anfang des Jahres 2000 wurde im Harnsystem von Katzen und Hunden ein Anstieg der Calciumoxalatsteine beobachtet. Es scheint, dass dies von der Art der Ernährung abhängt, die diese Tiere essen, und mit dem Säuregehalt des Urins und dem Magnesiummangel (Mg) zu tun hat.
Körperreaktion auf überschüssiges Oxalat
Es gibt Hinweise darauf, dass sowohl Menschen als auch Tiere auf überschüssiges Oxalat reagieren, indem sie die Anzahl der Bakterien erhöhen, die Oxalat abbauen können..
Einige dieser Bakterien sind Oxalobacter formigenes, Bifidobacterium sp., Porphyromonas gingivalis Y. Bacillus sp., unter anderem und sind natürlich im Darm vorhanden.
Anwendungen
Nach den konsultierten Quellen wird Calciumoxalat in der Keramikbeschichtung verwendet.
Es wurde verwendet, um Kalksteinskulpturen und andere künstlerische Elemente zu beschichten, und es wurde festgestellt, dass es die Härte des Materials verbessert, seine Porosität verringert und seine Beständigkeit gegen Säuren und Laugen erhöht..

Probleme in einigen Prozessen
In der Zellstoff- und Papierindustrie kann Calciumoxalat Ablagerungen bilden, die viele Probleme im Prozess verursachen..
Um seine Bildung in den Kanälen oder Rohren industrieller Prozesse zu verhindern, wurde der enzymatische Abbau von Oxalsäure mittels Enzymen wie Oxalatoxidase vorgeschlagen..
Es neigt auch dazu, sich wie Stein in den Behältern anzusammeln, in denen Bier hergestellt wird. Dort muss es entfernt werden, um die Bildung von Mikroorganismen zu vermeiden, die dem Getränk einen unangenehmen Geschmack verleihen können..
Risiken
In hohen Konzentrationen kann Oxalat bei Tieren und gelegentlich beim Menschen zum Tod führen, hauptsächlich aufgrund seiner ätzenden Wirkung..
Die Bildung von Oxalat und seiner konjugierten Säure, Oxalsäure, kann Störungen wie Herzfehlfunktionen, Calciumoxalatsteine, Nierenversagen und sogar den Tod durch Toxizität verursachen.
Verweise
- Glasauer, S.M. et al. (2013). Metalle und Metalloide, Transformation durch Mikroorganismen. Oxalate. Im Referenzmodul für Erdsysteme und Umweltwissenschaften. Von sciencedirect.com wiederhergestellt.
- Baumann, J. M. und Casella, R. (2019). Prävention der Calciumnephrolithiasis: Der Einfluss der Diurese auf die Calciumoxalatkristallisation im Urin. Adv Prev Med, 2019; 2019: 3234867. Von ncbi.nlm.nih.gov wiederhergestellt.
- Breshears, M.A. und Confer, A.W. (2017). Das Harnsystem. Calciumoxalat-Kalküle. In Pathologic Basis of Veterinary Disease (Sechste Ausgabe). Von sciencedirect.com wiederhergestellt.
- Huang, Y. er al. (2019). Umgang mit Oxalat im Körper und Ursprung von Oxalat in Calciumoxalat-Steinen. Urol Int, 2019, 5. Dezember: 1-10. Von ncbi.nlm.nih.gov wiederhergestellt.
- Nilvebrant, N.-O. et al. (2002). Biotechnologie in der Zellstoff- und Papierindustrie. In Bearbeitung in der Biotechnologie. Von sciencedirect.com wiederhergestellt.
- Pahira, J.J. und Pevzner, M. (2007). Nephrolithiasis. Calciumsteine. Im Penn Clinical Manual of Urology. Von sciencedirect.com wiederhergestellt.
- Worcester, E. M. (1994). Calciumoxalat-Kristallwachstumshemmer im Urin. J Am Soc Nephrol 1994 Nov; 5 (5 Suppl 1): S46-53). Von jasn.asnjournals.org wiederhergestellt.
- Finkielstein, V.A. und Goldfarb, D.S. (2006). Strategien zur Verhinderung von Calciumoxalatsteinen. Von ncbi.nlm.nih.gov wiederhergestellt.
- UNS. Nationalbibliothek für Medizin. (2019). Kalziumoxalat. Von pubchem.ncbi.nlm.nih.gov wiederhergestellt.
- Peck, A.B. et al. (2015). Oxalat abbauende Mikroorganismen oder Oxalat abbauende Enzyme: Welches ist die zukünftige Therapie zur enzymatischen Auflösung von Calciumoxalat-Urolithen bei wiederkehrenden Steinkrankheiten? Urolithiasis, 2016 Feb; 44 (1): 27 & ndash; 32. Von ncbi.nlm.nih.gov wiederhergestellt.
- Holames, R.P. et al. (2016). Senkung der Oxalatausscheidung im Urin zur Verringerung der Calciumoxalat-Steinkrankheit. Urolithiasis. 2016 Februar; 44 (1); 27-32. Von ncbi.nlm.nih.gov wiederhergestellt.
- Cezar, T.M. (1998). Calciumoxalat: Eine Oberflächenbehandlung für Kalkstein. Journal of Conservation and Museum Studies 4, S. 6-10. Von jcms-journal.com wiederhergestellt.
- Wikimedia (2019). Kalziumoxalat. Von en.wikipedia.org wiederhergestellt.


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.