
Sekundäre Alkoholstruktur, Eigenschaften, Nomenklatur, Verwendung
EIN sekundärer Alkohol Es hat den Trägerkohlenstoff der Hydroxylgruppe (OH), der an zwei Kohlenstoffe gebunden ist. Während in primärem Alkohol der Kohlenstoff, der die Hydroxylgruppe trägt, an ein Kohlenstoffatom und in tertiärem Alkohol an drei Kohlenstoffatome gebunden ist..
Alkohole sind etwas schwächere Säuren als Wasser mit folgendem pKa: Wasser (15,7); Methylalkohole (15,2), Ethyl (16), Isopropylalkohole (17) und tert-Butylalkohole (18). Wie zu sehen ist, ist Isopropylalkohol weniger sauer als Methyl- und Ethylalkohole..
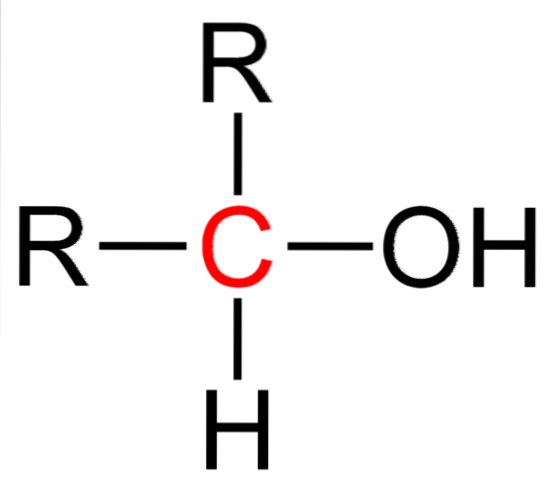
Das obere Bild zeigt die Strukturformel für einen sekundären Alkohol. Der rote Kohlenstoff ist der Träger des OH und an zwei Alkyl- (oder Aryl-) Gruppen R und ein einzelnes Wasserstoffatom gebunden.
Alle Alkohole haben die generische Formel ROH; Wenn jedoch der Trägerkohlenstoff im Detail beobachtet wird, dann die primären Alkohole (RCHzweiOH), sekundär (R.zweiCHOH, hier angehoben) und tertiär (R.3COH). Diese Tatsache macht einen Unterschied in seinen physikalischen Eigenschaften und seiner Reaktivität..
Artikelverzeichnis
- 1 Struktur eines sekundären Alkohols
- 2 Eigenschaften
- 2.1 Siedepunkte
- 2.2 Säure
- 2.3 Reaktionen
- 3 Nomenklatur
- 4 Verwendungen
- 5 Beispiele
- 5,1 2-Octanol
- 5.2 Estradiol oder 17β-Estradiol
- 5,3 20-Hydroxy-Leukotrien
- 5,4 2-Heptanol
- 6 Referenzen
Struktur eines sekundären Alkohols
Die Strukturen der Alkohole hängen von der Art der R-Gruppen ab. Für sekundäre Alkohole können jedoch einige Beispiele angeführt werden, wenn man bedenkt, dass es nur lineare Strukturen mit oder ohne Verzweigungen oder cyclische Strukturen geben kann. Zum Beispiel haben Sie das folgende Bild:
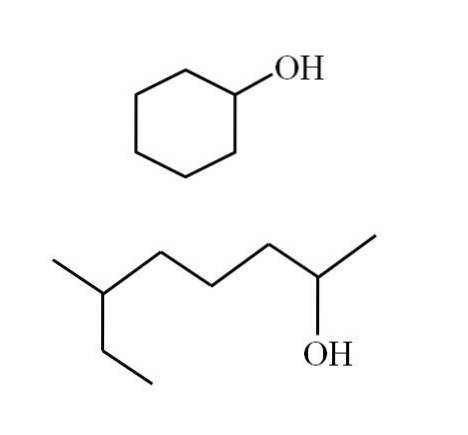
Beachten Sie, dass für beide Strukturen etwas gemeinsam ist: Das OH ist mit einem "V" verbunden. Jedes Ende des V repräsentiert eine gleiche R-Gruppe (oberer Teil des Bildes, zyklische Struktur) oder eine andere (unterer Teil, verzweigte Kette)..
Auf diese Weise kann jeder sekundäre Alkohol sehr leicht identifiziert werden, auch wenn seine Nomenklatur überhaupt nicht bekannt ist..
Eigenschaften
Siedepunkte
Die Eigenschaften von sekundären Alkoholen unterscheiden sich physikalisch nicht zu sehr von anderen Alkoholen. Sie sind normalerweise transparente Flüssigkeiten, und um bei Raumtemperatur ein Feststoff zu sein, müssen mehrere Wasserstoffbrückenbindungen gebildet werden und eine hohe Molekülmasse aufweisen.
Die gleiche Strukturformel R.zweiCHOH weist auf bestimmte Eigenschaften hin, die für diese Alkohole im Allgemeinen einzigartig sind. Beispielsweise ist die OH-Gruppe weniger exponiert und für Wasserstoffbrücken verfügbar, R.zweiCH-OH-OHCHRzwei.
Dies liegt daran, dass die R-Gruppen neben dem OH-tragenden Kohlenstoff im Weg stehen und die Bildung von Wasserstoffbrückenbindungen behindern können. Infolgedessen haben sekundäre Alkohole niedrigere Siedepunkte als primäre Alkohole (RCH)zweiOH).
Säure
Nach der Brönsted-Lowry-Definition ist eine Säure eine Säure, die Protonen oder Wasserstoffionen H abgibt+. Wenn dies mit einem sekundären Alkohol geschieht, haben Sie:
R.zweiCHOH + B.- => R.zweiCHO- + HB
Die konjugierte Base R.zweiCHO-, Alkoxidanion muss seine negative Ladung stabilisieren. Für den sekundären Alkohol ist die Stabilisierung geringer, da die beiden R-Gruppen eine elektronische Dichte aufweisen, die die negative Ladung am Sauerstoffatom bis zu einem gewissen Grad abstößt..
In der Zwischenzeit wurde für das Alkoxidanion eines primären Alkohols RCHzweiODER-, Es gibt weniger elektronische Abstoßung, da es nur eine R-Gruppe und nicht zwei gibt. Außerdem üben die Wasserstoffatome keine signifikante Abstoßung aus und tragen im Gegenteil zur Stabilisierung der negativen Ladung bei..
Daher sind sekundäre Alkohole weniger sauer als primäre Alkohole. Wenn dies so ist, dann sind sie grundlegender und aus genau den gleichen Gründen:
R.zweiCHOH + H.zweiB.+ => R.zweiCHOHzwei+ + HB
Nun stabilisieren die R-Gruppen die positive Ladung auf Sauerstoff, indem sie einen Teil seiner Elektronendichte abgeben..
Reaktionen
Halogenwasserstoff und Phosphortrihalogenid
Ein sekundärer Alkohol kann mit einem Halogenwasserstoff reagieren. Die chemische Gleichung der Reaktion zwischen Isopropylalkohol und Bromwasserstoffsäure in einem Schwefelsäuremedium und der Herstellung von Isopropylbromid ist gezeigt:
CH3CHOHCH3 + HBr => CH3CHBrCH3 + H.zweiODER
Und es kann auch mit einem Phosphor-Trihalogen, PX, reagieren3 (X = Br, I):
CH3-CHOH-CHzwei-CHzwei-CH3 + PBr3 => CH3-CHBr-CHzwei-CHzwei-CH3 + H.3PO3
Die obige chemische Gleichung entspricht der Reaktion zwischen Sec-Pentanol und Phosphortribromid, wobei sec-Pentylbromid entsteht.
Es ist zu beachten, dass in beiden Reaktionen ein sekundäres Alkylhalogenid (R.zweiCHX).
Dehydration
Bei dieser Reaktion gehen ein H und ein OH aus benachbarten Kohlenstoffen verloren und bilden eine Doppelbindung zwischen diesen beiden Kohlenstoffatomen. Daher bildet sich ein Alken. Die Reaktion erfordert einen sauren Katalysator und die Zufuhr von Wärme.
Alkohol => Alken + H.zweiODER
Zum Beispiel haben wir die folgende Reaktion:
Cyclohexanol => Cyclohexen + H.zweiODER
Reaktion mit aktiven Metallen
Sekundäre Alkohole können mit Metallen reagieren:
CH3-CHOH-CH3 + K => CH3CHO-K.+CH3 + ½ H.+
Hier reagiert Isopropylalkohol mit Kalium unter Bildung des Isoproxidsalzes von Kalium- und Wasserstoffionen..
Veresterung
Der sekundäre Alkohol reagiert mit einer Carbonsäure unter Bildung eines Esters. Zum Beispiel ist die chemische Gleichung für die Reaktion von sec-Butylalkohol mit Essigsäure zur Herstellung von sec-Butylacetat gezeigt:
CH3CHOHCHzweiCH3 + CH3COOH <=> CH3COOCHCH3CHzweiCH3
Oxidation
Primäre Alkohole werden zu Aldehyden oxidiert und diese wiederum zu Carbonsäuren oxidiert. Die sekundären Alkohole werden jedoch zu Aceton oxidiert. Reaktionen werden üblicherweise durch Kaliumdichromat (K) katalysiertzweiCrO7) und Chromsäure (H.zweiCrO4).
Die Gesamtreaktion ist:
R.zweiCHOH => R.zweiC = O.
Nomenklatur
Sekundäre Alkohole geben die Position der OH-Gruppe in der Hauptkette (längste Kette) an. Diese Nummer steht vor dem Namen oder kann nach dem Namen des jeweiligen Alkans für diese Kette stehen.
Zum Beispiel der CH3CHzweiCHzweiCHzweiCHOHCH3, ist 2-Hexanol oder Hexan-2-ol.
Wenn die Struktur zyklisch ist, muss kein Zähler platziert werden. es sei denn, es gibt andere Substituenten. Aus diesem Grund wird der cyclische Alkohol im zweiten Bild als Cyclohexanol bezeichnet (der Ring ist hexagonal)..
Und für den anderen Alkohol des gleichen Bildes (den verzweigten) heißt er: 6-Ethylheptan-2-ol.
Anwendungen
-Sec-Butanol wird als Lösungsmittel und chemisches Zwischenprodukt verwendet. Es ist in Hydraulikflüssigkeiten für Bremsen, Industriereiniger, Polituren, Abbeizmittel, Mineralflotationsmittel sowie Fruchtessenzen und -parfums enthalten..
-Isopropanolalkohol wird als industrielles Lösungsmittel und als Antikoagulans verwendet. Es wird in Ölen und schnell trocknenden Tinten als Antiseptikum und Ersatz für Ethanol in Kosmetika verwendet (z. B. Hautlotionen, Haartoner und Reinigungsalkohol)..
-Isopropanol ist Bestandteil von Flüssigseifen, Glasreinigern, synthetischen Aromen in alkoholfreien Getränken und Lebensmitteln. Darüber hinaus ist es eine Zwischenchemikalie.
-Cyclohexanol wird als Lösungsmittel, bei der Textilveredelung, bei der Lederverarbeitung und als Emulgator in Seifen und synthetischen Reinigungsmitteln verwendet..
-Methylcyclohexanol ist ein Bestandteil von Fleckenentfernern auf Seifenbasis und speziellen Textilwaschmitteln.
Beispiele
2-Octanol

Es ist ein Fettalkohol. Es ist eine farblose Flüssigkeit, die in Wasser schwer löslich ist, aber in den meisten unpolaren Lösungsmitteln löslich ist. Es wird unter anderem zur Herstellung von Aromen und Duftstoffen, Farben und Beschichtungen, Tinten, Klebstoffen, häuslicher Pflege und Schmiermitteln verwendet.
Estradiol oder 17β-Estradiol

Es ist ein Steroid-Sexualhormon. Es hat zwei Hydroxylgruppen in seiner Struktur. Es ist das vorherrschende Östrogen während der Fortpflanzungsjahre.
20-Hydroxy-Leukotrien
Es ist ein Metabolit, der wahrscheinlich aus der Oxidation von Leukotrienlipid stammt. Es wird als Cystinylleukotrien klassifiziert. Diese Verbindungen sind Mediatoren des Entzündungsprozesses, der zu den pathophysiologischen Eigenschaften der allergischen Rhinitis beiträgt..
2-Heptanol
Es ist ein Alkohol, der in Früchten vorkommt. Es ist auch in Ingweröl und Erdbeeren enthalten. Es ist transparent, farblos und wasserunlöslich. Es wird als Lösungsmittel für verschiedene Harze verwendet und greift in die Flotationsphase bei der Mineralverarbeitung ein.
Verweise
- James. (17. September 2014). Alkohole (1) - Nomenklatur und Eigenschaften. Wiederhergestellt von: masterorganicchemistry.com
- Enzyklopädie für Gesundheit und Sicherheit am Arbeitsplatz. (s.f.). Alkohole. [PDF]. Wiederhergestellt von: insht.es
- Clark J. (16. Juli 2015). Struktur und Klassifizierung von Alkoholen. Chemie-Libretexte. Wiederhergestellt von: chem.libretexts.org
- PubChem. (2019). 20-Hydroxy-Leukotrien E4. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Morrison, R. T. und Boyd, R., N. (1987). Organische Chemie. 5ta Auflage. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons T. W., Craig B. Fryhle. (2011). Organische Chemie. Amine. (10th Auflage.). Wiley plus.
- Wikipedia. (2018). 2-Octanol. Wiederhergestellt von: en.wikipedia.org



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.