
Primäre Alkoholstruktur, Eigenschaften, Nomenklatur, Beispiele
EIN primärer Alkohol ist eine, bei der die Hydroxylgruppe an einen primären Kohlenstoff gebunden ist; das heißt, ein Kohlenstoff, der kovalent an einen anderen Kohlenstoff und Wasserstoff gebunden ist. Die allgemeine Formel lautet ROH, insbesondere RCHzweiOH, da es nur eine Alkylgruppe R gibt.
Die R-Gruppe der Formel RCHzweiOH kann eine beliebige sein: eine Kette, ein Ring oder Heteroatome. Wenn es um eine kurze oder lange Kette geht, haben wir es mit den repräsentativsten primären Alkoholen zu tun. Darunter befinden sich Methanol und Ethanol, zwei der auf industrieller Ebene am meisten synthetisierten.

Physikalisch sind sie wie andere Alkohole und ihre Siede- oder Schmelzpunkte hängen vom Grad ihrer Verzweigung ab; aber chemisch sind sie am reaktivsten. Darüber hinaus ist sein Säuregehalt höher als der von sekundären und tertiären Alkoholen.
Primäre Alkohole gehen Oxidationsreaktionen ein und werden zu einer großen Anzahl organischer Verbindungen: Ester und Ether, Aldehyde und Carbonsäuren. Ebenso können sie Dehydratisierungsreaktionen eingehen und sich in Alkene oder Olefine umwandeln.
Artikelverzeichnis
- 1 Struktur eines primären Alkohols
- 2 Eigenschaften
- 2.1 Säure
- 2.2 Chemische Reaktionen
- 3 Nomenklatur
- 4 Beispiele
- 5 Referenzen
Struktur eines primären Alkohols
Die von linearen Alkanen abgeleiteten primären Alkohole sind am repräsentativsten. In der Realität kann jedoch jede Struktur, ob linear oder verzweigt, innerhalb dieser Art von Alkoholen klassifiziert werden, solange die OH-Gruppe an ein CH gebunden istzwei.
Strukturell haben sie alle die Anwesenheit der Gruppe -CH gemeinsamzweiOH, genannt Methylol. Ein Merkmal und eine Konsequenz dieser Tatsache ist, dass die OH-Gruppe weniger behindert ist; Das heißt, es kann ohne räumliche Interferenz durch andere Atome mit der Umgebung interagieren.
Ebenso bedeutet ein weniger gehindertes OH, dass das Kohlenstoffatom, das es trägt, das des CH istzwei, kann Substitutionsreaktionen durch einen SN-Mechanismus eingehenzwei (bimolekular, ohne Bildung eines Carbokations).
Andererseits wird ein OH mit größerer Freiheit zur Wechselwirkung mit dem Medium als stärkere intermolekulare Wechselwirkungen (durch Wasserstoffbrückenbindungen) übersetzt, die wiederum die Schmelz- oder Siedepunkte erhöhen.
Gleiches gilt für die Löslichkeit in polaren Lösungsmitteln, solange die R-Gruppe nicht sehr hydrophob ist..
Eigenschaften
Säure
Die primären Alkohole sind am sauersten. Damit sich ein Alkohol wie eine Brönsted-Säure verhält, müssen Sie ein H-Ion spenden+ zum Medium, um Wasser zu sagen, um ein Alkoxidanion zu werden:
ROH + H.zweiODER <=> RO- + H.3ODER+
Die negative Ladung von RO-, speziell aus dem RCHzweiODER-, wird von den Elektronen in den beiden C-H-Bindungen weniger abgestoßen als von den Elektronen in der C-R-Bindung.
Die Alkylgruppe übt dann die größte Abstoßung aus und destabilisiert RCHzweiODER-;; aber nicht so sehr im Vergleich zu zwei oder drei R-Gruppen, wie dies bei sekundären bzw. tertiären Alkoholen der Fall ist.
Eine andere Möglichkeit, den höheren Säuregehalt eines primären Alkohols zu erklären, besteht in der Elektronegativitätsdifferenz, die das Dipolmoment erzeugt: H.zweiC.δ+-ODERδ-H. Sauerstoff zieht die Elektronendichte von beiden CH anzwei wie von H; Die positive Teilladung von Kohlenstoff stößt die von Wasserstoff ein wenig ab.
Die R-Gruppe überträgt einen Teil ihrer Elektronendichte auf das CHzwei, Dies hilft, seine positive Teilladung und damit seine Abstoßung für die Wasserstoffladung zu verringern. Je mehr R-Gruppen es gibt, desto geringer ist die Abstoßung und damit die Tendenz, dass H als H freigesetzt wird+.
pKa
Primäre Alkohole gelten als schwächere Säuren als Wasser, mit Ausnahme von Methylalkohol, der etwas stärker ist. Der pKa von Methylalkohol beträgt 15,2; und der pKa von Ethylalkohol beträgt 16,0. Inzwischen beträgt der pKa von Wasser 15,7.
Wasser, das wie Alkohole als schwache Säure gilt, kann jedoch an H binden+ in das Hydroniumion umzuwandeln, H.3ODER+;; das heißt, es verhält sich als Basis.
Ebenso können primäre Alkohole Wasserstoff aufnehmen; insbesondere bei einigen seiner eigenen Reaktionen, zum Beispiel bei der Umwandlung in Alkene oder Olefine.
Chemische Reaktionen
Bildung von Alkylhalogeniden
Alkohole reagieren mit Halogenwasserstoffen unter Bildung von Alkylhalogeniden. Die Reaktivität von Alkoholen gegenüber Halogenwasserstoffen nimmt in der folgenden Reihenfolge ab:
Tertiärer Alkohol> sekundärer Alkohol> primärer Alkohol
ROH + HX => RX + H.zweiODER
RX ist ein primäres Alkylhalogenid (CH3Cl, CH3CHzweiBr, etc.).
Eine andere Möglichkeit zur Herstellung von Alkylhalogeniden besteht darin, Thionylchlorid, ein synthetisches Reagenz, mit einem primären Alkohol zu reagieren, der in ein Alkylchlorid umgewandelt wird. Thionylchlorid (SOClzwei) erfordert die Anwesenheit von Pyridin, um zu reagieren.
CH3(CHzwei)3CHzweiOH + SOClzwei => CH3(CHzwei)3CHzweiCl + SOzwei + HCl
Diese Reaktion entspricht der Halogenierung von 1-Pentanol zu 1-Chlorpentan in Gegenwart von Pyridin.
Oxidation von primären Alkoholen
Alkohole können je nach Reagenz zu Aldehyden und Carbonsäuren oxidiert werden. Pyridiniumchlorochromat (PCC) oxidiert primären Alkohol unter Verwendung von Dichlormethan (CH) zu AldehydzweiClzwei):
CH3(CHzwei)5CHzweiOH => CH3(CHzwei)5COH
Dies ist die Oxidation von 1-Heptanol zu 1-Heptanal.
Inzwischen Kaliumpermanganat (KMnO4) oxidiert zuerst den Alkohol zu Aldehyd und oxidiert dann den Aldehyd zu Carbonsäure. Wenn Kaliumpermanganat zur Oxidation von Alkoholen verwendet wird, muss das Aufbrechen der Bindung zwischen den Kohlenstoffen 3 und 4 vermieden werden..
CH3(CHzwei)4CHzweiOH => CH3(CHzwei)4COOH
Dies ist die Oxidation von 1-Hexanol zu Hexansäure.
Durch dieses Verfahren ist es schwierig, einen Aldehyd zu erhalten, da er leicht zu einer Carbonsäure oxidiert wird. Eine ähnliche Situation wird beobachtet, wenn Chromsäure zur Oxidation von Alkoholen verwendet wird.
Bildung von Ethern
Primäre Alkohole können beim Erhitzen in Gegenwart eines Katalysators, üblicherweise Schwefelsäure, in Ether umgewandelt werden:
2 RCHzweiOH => RCHzweiOCHzweiR + H.zweiODER
Bildung organischer Ester
Die Kondensation eines Alkohols und einer Carbonsäure, die durch eine Säure katalysierte Fisher-Veresterung, erzeugt einen Ester und Wasser:
R'OH + RCOOH <=> RCOOR '+ H.zweiODER
Eine bekannte Reaktion ist die von Ethanol mit Essigsäure zu Ethylacetat:
CH3CHzweiOH + CH3COOH <=> CH3COOHCHzweiCH3 + H.zweiODER
Primärer Alkohol ist am anfälligsten für Fischer-Veresterungsreaktionen.
Dehydration
Bei hohen Temperaturen und in einem sauren Medium, im Allgemeinen Schwefelsäure, dehydrieren Alkohole unter Bildung von Alkenen unter Verlust eines Wassermoleküls.
CH3CHzweiOH => H.zweiC = CHzwei + H.zweiODER
Dies ist die Dehydratisierungsreaktion von Ethanol zu Ethylen. Eine geeignetere allgemeine Formel für diese Art von Reaktion, speziell für einen primären Alkohol, wäre:
RCHzweiOH => R = CHzwei (was auch gleich RC = CH istzwei)
Nomenklatur
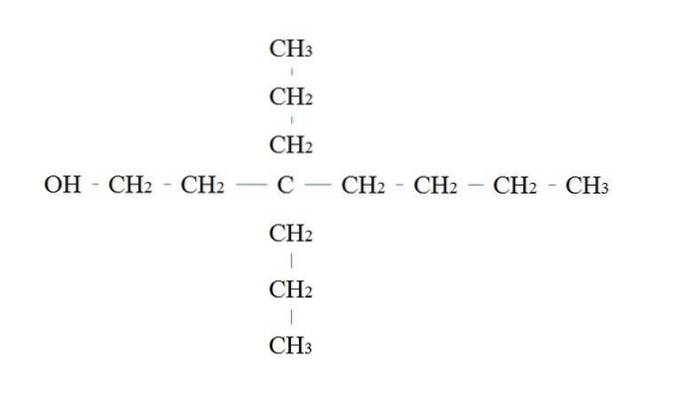
Die Regeln für die Benennung eines primären Alkohols sind dieselben wie für die anderen Alkohole. mit der Ausnahme, dass es manchmal nicht notwendig ist, den OH-tragenden Kohlenstoff aufzulisten.
Im oberen Bild befindet sich eine Hauptkette mit sieben Kohlenstoffatomen. Dem an das OH gebundenen Kohlenstoff wird die Nummer 1 zugewiesen, und dann beginnt er von links nach rechts gezählt zu werden. Sein IUPAC-Name lautet daher: 3,3-Diethylheptanol.
Beachten Sie, dass dies ein Beispiel für einen stark verzweigten primären Alkohol ist.
Beispiele
Schließlich werden einige primäre Alkohole aufgrund ihrer traditionellen und systematischen Nomenklatur erwähnt:
-Methyl, CH3Oh
-Ethyl, CH3CHzweiOh
-n-Propyl, CH3CHzweiCHzweiOh
-n-Hexyl, CH3CHzweiCHzweiCHzweiCHzweiCHzweiOh
Dies sind Derivate linearer Alkane. Andere Beispiele sind:
-2-Phenylethanol, C.6H.5CHzweiCHzweiOH (C.6H.5 = Benzolring)
-2-Propen-1-ol (Allylalkohol), CHzwei= CHCHzweiOh
-1,2-Ethandiol, CHzweiOHCHzweiOh
-2-Chlorethanol (Ethylenchlorhydrin), ClCHzweiCHzweiOh
-2-Buten-1-ol (Crotylalkohol), CH3CH = CHCHzweiOh
Verweise
- Morrison, R.T. und Boyd, R. N. (1987). Organische Chemie. (5ta Auflage). Addison-Wesley Iberoamericana
- Carey, F. A. (2008). Organische Chemie. (6ta Auflage). McGraw-Hill, Interamerica, Herausgeber S.A..
- Mel Wissenschaft. (2019). Wie die Oxidation von primären Alkoholen stattfindet. Wiederhergestellt von: melscience.com
- Royal Society of Chemistry. (2019). Definition: primäre Alkohole. Wiederhergestellt von: rsc.org
- Chriss E. McDonald. (2000). Die Oxidation von primären Alkoholen zu Estern: Drei verwandte Untersuchungsexperimente. J. Chem. Educ., 2000, 77 (6), S. 750. DOI: 10.1021 / ed077p750


Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.