
Struktur, Eigenschaften und Verwendung von Iodwasserstoffsäure (HI)

Das Iodwasserstoffsäure Es ist eine wässrige Jodwasserstofflösung, die sich durch ihren hohen Säuregehalt auszeichnet. Eine Definition, die der chemischen und IUPAC-Terminologie näher kommt, ist, dass es sich um ein Hydracid handelt, dessen chemische Formel HI ist.
Um es jedoch von gasförmigen Iodwasserstoffmolekülen zu unterscheiden, wird HI (g) als HI (aq) bezeichnet. Aus diesem Grund ist es in chemischen Gleichungen wichtig, das Medium oder die physikalische Phase zu identifizieren, in der sich die Reaktanten und Produkte befinden. Trotzdem kommt es häufig zu Verwechslungen zwischen Jodwasserstoff und Iodwasserstoffsäure..
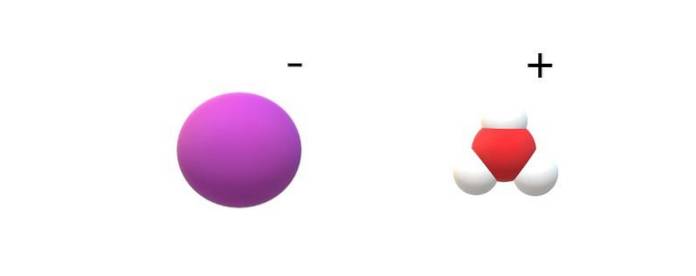
Wenn die in ihrer Identität gebundenen Moleküle beobachtet werden, werden merkliche Unterschiede zwischen HI (g) und HI (ac) gefunden. In HI (g) gibt es eine H-I-Bindung; während sie in HI (ac) sind, sind sie tatsächlich ein Ionenpaar I.- und H.3ODER+ elektrostatisch interagieren (oberes Bild).
Andererseits ist HI (ac) eine Quelle für HI (g), da das erste durch Auflösen des zweiten in Wasser hergestellt wird. Aus diesem Grund kann HI, sofern es sich nicht um eine chemische Gleichung handelt, auch für Iodwasserstoffsäure verwendet werden. HI ist ein starkes Reduktionsmittel und eine ausgezeichnete Quelle für I-Ionen.- in wässrigem Medium.
Artikelverzeichnis
- 1 Struktur von Iodwasserstoffsäure
- 2 Eigenschaften
- 2.1 Physikalische Beschreibung
- 2.2 Molekularmasse
- 2.3 Geruch
- 2.4 Dichte
- 2,5 Siedepunkt
- 2,6 pKa
- 2.7 Säure
- 2.8 Reduktionsmittel
- 3 Nomenklatur
- 4 Verwendungen
- 4.1 Jodquelle in organischen und anorganischen Synthesen
- 4.2 Reduktionsmittel
- 4.3 Cativa-Prozess
- 4.4 Illegale Synthesen
- 5 Referenzen
Struktur der Iodwasserstoffsäure
Iodwasserstoffsäure besteht, wie gerade erläutert, aus einer Lösung von HI in Wasser. In Wasser dissoziieren die HI-Moleküle vollständig (starker Elektrolyt), wodurch die I-Ionen entstehen- und H.3ODER+. Diese Dissoziation kann durch die folgende chemische Gleichung dargestellt werden:
HI (g) + H.zweiO (l) => I.-(ac) + H.3ODER+(ac)
Was wäre gleichbedeutend, wenn es geschrieben würde als:
HI (g) + H.zweiO (l) => HI (ac)
HI (ac) zeigt jedoch überhaupt nicht, was mit den gasförmigen HI-Molekülen geschehen ist; es zeigt nur an, dass sie sich in einem wässrigen Medium befinden.
Daher besteht die wahre Struktur von HI (ac) aus den Ionen I.- und H.3ODER+ umgeben von Wassermolekülen, die sie hydratisieren; Je konzentrierter die Iodwasserstoffsäure ist, desto geringer ist die Anzahl der nicht protonierten Wassermoleküle.
Kommerziell beträgt die HI-Konzentration in Wasser tatsächlich 48 bis 57%; Konzentrierter wäre gleichbedeutend mit zu rauchender Säure (und noch gefährlicher).
Auf dem Bild ist zu sehen, dass das Anion I.- wird durch eine lila Kugel dargestellt, und H.3ODER+ mit weißen und einer roten Kugel für das Sauerstoffatom. Das Kation H.3ODER+ Merkmale der Molekülgeometrie der trigonalen Pyramide (von einer höheren Ebene im Bild aus gesehen).
Eigenschaften
Physische Beschreibung
Farblose Flüssigkeit; Es kann jedoch gelbliche und braune Töne aufweisen, wenn es in direktem Kontakt mit Sauerstoff steht. Dies liegt daran, dass die Ionen I.- am Ende oxidiert zu molekularem Jod, ichzwei. Wenn es viel gibt, ichzwei, es ist mehr als wahrscheinlich, dass das Triiodidanion gebildet wird, I.3-, was die Lösung braun färbt.
Molekulare Masse
127,91 g / mol.
Geruch
Acre.
Dichte
Die Dichte beträgt 1,70 g / ml für die 57% ige HI-Lösung; da die Dichten in Abhängigkeit von den unterschiedlichen Konzentrationen von HI variieren. Bei dieser Konzentration wird ein Azeotrop gebildet (es wird als einzelne Substanz und nicht als Gemisch destilliert), auf dessen relative Stabilität es aufgrund seiner Kommerzialisierung gegenüber anderen Lösungen zurückzuführen sein kann..
Siedepunkt
Das 57% HI-Azeotrop siedet bei 127 ° C bei einem Druck von 1,03 bar (GO TO ATM).
pKa
-1,78.
Säure
Es ist eine extrem starke Säure, die alle Metalle und Gewebe angreift. auch für Gummi.
Dies liegt daran, dass die H-I-Bindung sehr schwach ist und während der Ionisation in Wasser leicht bricht. Weiterhin werden Wasserstoffbrücken I.- - HOHzwei+ sind schwach, so gibt es nichts, was das H stören könnte3ODER+ mit anderen Verbindungen reagieren; das heißt, der H.3ODER+ war "frei", wie das ich- das zieht sein Gegenion nicht mit zu viel Kraft an.
Reduktionsmittel
HI ist ein starkes Reduktionsmittel, dessen Hauptreaktionsprodukt I istzwei.
Nomenklatur
Die Nomenklatur für Iodwasserstoffsäure leitet sich aus der Tatsache ab, dass Jod mit einer einzigen Oxidationsstufe "arbeitet": -1. Der gleiche Name weist auch darauf hin, dass die Strukturformel Wasser enthält [I.-] [H.3ODER+]. Dies ist der einzige Name, da es sich nicht um eine reine Verbindung, sondern um eine Lösung handelt.
Anwendungen
Jodquelle in organischen und anorganischen Synthesen
HI ist eine ausgezeichnete Quelle für Ionen I.- für anorganische und organische Synthesen und ist auch ein starkes Reduktionsmittel. Beispielsweise wird seine 57% ige wässrige Lösung zur Synthese von Alkyliodiden (wie CH) verwendet3CHzweiI) aus primären Alkoholen. Ebenso kann ein OH in einer Struktur durch eine OH-Gruppe ersetzt werden.
Reduktionsmittel
Iodwasserstoffsäure wurde verwendet, um beispielsweise Kohlenhydrate zu reduzieren. Wenn in dieser Säure gelöste Glucose erhitzt wird, verliert sie alle ihre OH-Gruppen und erhält den Kohlenwasserstoff n-Hexan als Produkt..
Ebenso wurde es verwendet, um die funktionellen Gruppen von Graphenschichten so zu reduzieren, dass sie für elektronische Geräte funktionalisiert werden können..
Cativa-Prozess

Schritte
Der Prozess beginnt (1) mit dem Organo-Iridium-Komplex [Ir (CO)zweiichzwei]]-, Quadratische Geometrie. Diese Verbindung "erhält" Methyliodid, CH3I, Produkt der Ansäuerung von CH3OH mit 57% HI. Bei dieser Reaktion wird auch Wasser erzeugt, und dank dieser wird schließlich Essigsäure erhalten, während das HI im letzten Schritt zurückgewonnen werden kann..
In diesem Schritt wird sowohl die Gruppe -CH3 wie -I binden sie an das Iridiummetallzentrum (2) und bilden einen oktaedrischen Komplex mit einer Facette aus drei I-Liganden. Eine der Ioden wird schließlich durch ein Molekül Kohlenmonoxid, CO, ersetzt; und jetzt (3) hat der oktaedrische Komplex eine Facette, die aus drei CO-Liganden besteht.
Dann erfolgt eine Umlagerung: die -CH-Gruppe3 es "löst" sich von Ir und bindet an benachbartes CO (4), um eine Acetylgruppe, -COCH, zu bilden3. Diese Gruppe wird aus dem Iridiumkomplex freigesetzt, um an Iodidionen zu binden und CH zu ergeben3COI, Acetyliodid. Hier wird der Iridiumkatalysator gewonnen, der bereit ist, an einem anderen Katalysezyklus teilzunehmen.
Schließlich ist der CH3Das IOC wird durch das I ersetzt- pro Molekül H.zweiO, dessen Mechanismus letztendlich HI und Essigsäure freisetzt.
Illegale Synthesen

Es ist ersichtlich, dass zuerst eine Substitution der OH-Gruppe für I erfolgt, gefolgt von einer zweiten Substitution für ein H..
Verweise
- Wikipedia. (2019). Iodwasserstoffsäure. Wiederhergestellt von: en.wikipedia.org
- Andrews, Natalie. (24. April 2017). Die Verwendung von Iodwasserstoffsäure. Wissenschaft. Wiederhergestellt von: sciencing.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Iodwasserstoffsäure. Wiederhergestellt von: alfa.com
- Nationales Zentrum für Informationen zur Biotechnologie. (2019). Iodwasserstoffsäure. PubChem Database., CID = 24841. Wiederhergestellt von: pubchem.ncbi.nlm.nih.gov
- Steven A. Hardinger. (2017). Illustriertes Glossar der Organischen Chemie: Iodwasserstoffsäure. Wiederhergestellt von: chem.ucla.edu
- Reusch William. (5. Mai 2013). Kohlenhydrate. Wiederhergestellt von: 2.chemistry.msu.edu
- In Kyu Moon, Junghyun Lee, Rodney S. Ruoff und Hyoyoung Lee. (2010). Reduziertes Graphenoxid durch chemische Graphitisierung. DOI: 10.1038 / ncomms1067.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.